题目内容
17. 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸.
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是B、E.
A.2mol/LNa2CO3溶液 B.品红溶液 C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2 E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
分析 实验探究在加热条件下FeSO4的分解产物,Ⅱ装置烧杯中水的温度应控制在50℃,防止SO3液化或凝固,装置III是检验是否有三氧化硫,可以选用氯化钡溶液,如果有白色沉淀生成说明有三氧化硫,装置IV是检验是否有二氧化硫,二氧化硫能使品红褪色,也可以使高锰酸钾溶液褪色,装置V中试剂为NaOH溶液吸收多余的二氧化硫气体防止污染空气,
(1)亚铁离子易被氧化具有还原性;
(2)①安全瓶的作用是可以防止倒吸;当温度高于44.8°C时三氧化硫为气体状态;
②装置III是检验是否有三氧化硫,装置IV是检验是否有二氧化硫,根据二者的性质选择试剂;
③二氧化硫会污染空气,要用氢氧化钠溶液来处理尾气;
④检验三价铁离子用硫氰化钾溶液;检验二价铁离子用K3[Fe(CN)6]溶液;
⑤反应过程中FeSO4固体分解为二氧化硫、三氧化硫、FeO、Fe2O3,完全分解后得到11.2g固体为氧化铁和氧化亚铁,质量减少的为二氧化硫和三氧化硫的总质量,据此列方程组计算.
解答 解:(1)亚铁离子具有还原性,易被氧气氧化,反应方程式为4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O,
故答案为:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O;
(2)①SO3的沸点是44.8°C,当温度高于44.8°C时三氧化硫为气体状态,把试管浸泡在50℃的热水浴中能防止SO3液化或凝固,产生的气体极易和溶液反应时,会产生倒吸,所以装置II的试管能防止溶液倒吸入装置Ⅰ中(或安全瓶),
故答案为:50℃;防止产生倒吸:
②装置III是检验是否有三氧化硫,可以选用氯化钡溶液,如果有白色沉淀生成说明有三氧化硫;装置IV是检验是否有二氧化硫,二氧化硫能使品红褪色,也能使酸性高锰酸钾溶液褪色,所以可以选用二者来检验二氧化硫;
故答案为:C;产生白色沉淀;B、E;
③二氧化硫会污染空气,所以要用氢氧化钠溶液来吸收剩余的二氧化硫,其反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O;
④检验三价铁离子用硫氰化钾溶液,溶液变红色,证明有三价铁离子,进而说明固体产物中含有氧化铁;检验二价铁离子用K3[Fe(CN)6]溶液,溶液中生成蓝色沉淀,说明有二价铁离子,即证明固体产物中含有FeO;
故答案为:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | |
| 固体中含有FeO |
⑤反应过程中FeSO4固体分解为二氧化硫、三氧化硫、FeO、Fe2O3,完全分解后得到11.2g固体为氧化铁和氧化亚铁,质量减少的为二氧化硫和三氧化硫的总质量,
设生成的二氧化硫为xmol,三氧化硫为ymol,
根据硫元素守恒,则x+y=$\frac{22.8g}{152g/mol}$=0.15mol,
64x+80y=22.8g-11.2g=11.6g,
解得:x=0.025,y=0.125,
FeSO4固体分解,每生成1mol二氧化硫时硫元素得到2mol电子,每生成1molFe2O3时铁元素失去2mol电子,所以生成的二氧化硫与氧化铁的物质的量相同,
则Fe2O3的物质的量为0.025mol,其质量为0.025mol×160g/mol=4.0g,
故质量分数为:$\frac{4.0g}{11.2g}$×100%=35.7%,
故答案为:35.7%.
点评 本题考查亚铁离子和三价铁离子之间的相互转化、性质及实验方案的设计、评价和有关计算的知识,掌握基础是解题关键,题目难度中等.

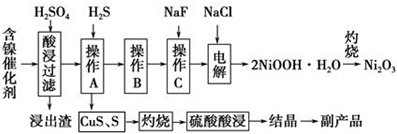
已知常温下:①有关氢氧化物开始沉淀和沉淀完pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
| A. | 通入CH4的电极为正极 | |
| B. | 正极的电极反应式为O2+4H++4e-═2H2O | |
| C. | 通入CH4的一极的电极反应式为CH4+2O2+4e-═CO2+2H2O | |
| D. | 负极的电极反应式为CH4+10OH--8e-═CO32-+7H2O |
| A. | 互称为同分异构体的物质不可能具有相同的通式 | |
| B. | 具有相同官能团的有机物不一定是同系物 | |
| C. | 糖类、油脂、蛋白质都是仅含C、H、O元素的有机物 | |
| D. | 燃烧产物是CO2、H2O的有机物一定烃类 |
Ksp(CaCO3)=2.8×10-9,Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=1.8×10-11.
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |

[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH> 7.0(填“>”、“<”、“﹦”),其原因是HCO3-+H2O?H2CO3+OH-(写离子方程式).
(2)如图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图.请结合图中数据回答:试剂Y的化学式为HCl;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH范围为8<pH<12.

(3)同学们发现,把MgCl2溶液蒸干、灼烧所得的白色固体难溶于水,你认为其主要成分是MgO.原因是(用化学方程式表示)MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2HCl↑、Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp=10-17.
| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | Ka1=1.54×10-2 |
| Ka2=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 在1mol•L-1NaHA(酸式盐)溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 已知某温度下常见弱酸的电离平衡常数如上表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 | |
| D. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH基本不变 |
 依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示: