题目内容
回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 )<c(SO32-),且H2SO3的电离平衡常数为K1=1.5×10-2K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;
则等物质的量浓度的下列五种溶液:①NH3?H2O ②(NH4)2CO3③KHSO3 ④KHCO3⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是 ,用离子方程式表示产生上述现象的原因: .
1)、已知常温下,在NaHSO3溶液中c(H2SO3 )<c(SO32-),且H2SO3的电离平衡常数为K1=1.5×10-2K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;
则等物质的量浓度的下列五种溶液:①NH3?H2O ②(NH4)2CO3③KHSO3 ④KHCO3⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是
考点:弱电解质在水溶液中的电离平衡,氧化还原反应,盐类水解的应用
专题:基本概念与基本理论
分析:1)、酸溶液和碱溶液抑制了水的电离,酸溶液中的氢离子、碱溶液中的氢氧根离子浓度越大,水的电离程度越小;能够水解的盐溶液促进了水的电离,水解程度越大,水的电离程度越大;
2)、NaHSO3被氧化为SO42-,同时KIO3被还原为碘离子;
3)、浓NH4Cl溶液中铵根离子水解导致溶液显示酸性,金属镁可以和酸之间反应生成氢气.
2)、NaHSO3被氧化为SO42-,同时KIO3被还原为碘离子;
3)、浓NH4Cl溶液中铵根离子水解导致溶液显示酸性,金属镁可以和酸之间反应生成氢气.
解答:
解:1)、设五种溶液的物质的量浓度均为c,
①NH3?H2O为弱碱,抑制了水的电离,溶液中氢氧离子浓度小于c,
②(NH4)2CO3为弱酸酸弱碱盐,发生了相互促进的水解,水解程度较大,
③KHSO3 在溶液中电离出氢离子显酸性,抑制的水的电离,溶液中氢离子浓度远小于c,
④KHCO3在溶液中水解显碱性,促进的水的电离,水解程度较小,
⑤Ba(OH)2为强碱,在溶液中电离出氢氧根离子,抑制了水的电离,溶液中氢氧离子浓度等于2c,
所以五种溶液中水的电离程度由大到小排列为:②④③①⑤,
故答案为:②④③①⑤;
2)、NaHSO3被氧化为SO42-,同时KIO3被还原为碘离子,其反应的离子方程式为:5HSO3-+2IO3-=I2+5SO42-+3H++H2O;
故答案为:5HSO3-+2IO3-=I2+5SO42-+3H++H2O;
3)、浓NH4Cl溶液中铵根离子水解导致溶液显示酸性,NH4++H2O?NH3?H2O+H+,加入金属镁,金属镁可以和酸之间反应生成氢气,Mg+2H+═Mg2++H2↑;此时反应过程实质是:Mg+2NH4+=Mg2++H2↑+2NH3↑;
故答案为:NH3、H2;Mg+2NH4+=Mg2++H2↑+2NH3↑.
①NH3?H2O为弱碱,抑制了水的电离,溶液中氢氧离子浓度小于c,
②(NH4)2CO3为弱酸酸弱碱盐,发生了相互促进的水解,水解程度较大,
③KHSO3 在溶液中电离出氢离子显酸性,抑制的水的电离,溶液中氢离子浓度远小于c,
④KHCO3在溶液中水解显碱性,促进的水的电离,水解程度较小,
⑤Ba(OH)2为强碱,在溶液中电离出氢氧根离子,抑制了水的电离,溶液中氢氧离子浓度等于2c,
所以五种溶液中水的电离程度由大到小排列为:②④③①⑤,
故答案为:②④③①⑤;
2)、NaHSO3被氧化为SO42-,同时KIO3被还原为碘离子,其反应的离子方程式为:5HSO3-+2IO3-=I2+5SO42-+3H++H2O;
故答案为:5HSO3-+2IO3-=I2+5SO42-+3H++H2O;
3)、浓NH4Cl溶液中铵根离子水解导致溶液显示酸性,NH4++H2O?NH3?H2O+H+,加入金属镁,金属镁可以和酸之间反应生成氢气,Mg+2H+═Mg2++H2↑;此时反应过程实质是:Mg+2NH4+=Mg2++H2↑+2NH3↑;
故答案为:NH3、H2;Mg+2NH4+=Mg2++H2↑+2NH3↑.
点评:本题考查了水的电离、盐的水解等,侧重于基本原理的应用的考查,题目难度中等,注意把握影响水的电离平衡的因素.

练习册系列答案
相关题目
在等物质的量浓度的两种弱酸的钠盐(NaR、NaR′)溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO3,2NaR′+CO2+H2O=2HR′+Na2CO3.现有物质的量浓度相同的四种溶液:①HR②HR′③NaR④NaR′,由水电离出c(OH-)大小顺序是( )
| A、①>②>③>④ |
| B、②>①>④>③ |
| C、③>④>①>② |
| D、④>③>②>① |
关于原电池、电解池的电极名称,下列说法错误的是( )
| A、原电池中失去电子的一极为负极 |
| B、电解池中与直流电源负极相连的一极为阴极 |
| C、原电池中相对活泼的一极为正极 |
| D、电解池中发生氧化反应的一极为阳极 |
下列说法正确的是( )
A、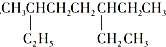 和 和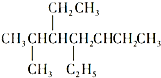 ,主链上碳原子数均为7个 ,主链上碳原子数均为7个 |
| B、主链含5个碳原子,有甲基、乙基2个支链的烷烃有三种 |
| C、新戊烷、正丁烷、异丁烷和丙烷的熔沸点依次降低 |
| D、C7H16的烷烃中,含有3个甲基的同分异构体有2种 |
 如图是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:


