题目内容
 如图是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:(1)实验中除量筒、烧杯、玻璃棒、胶头滴管外,还需要的其他仪器:
(2)计算所需浓硫酸的体积约为
(3)配制过程中需先在烧杯中将浓硫酸进行稀释.稀释的操作方法是
(4)下列操作会引起所配溶液浓度偏大的是
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.向容量瓶中转移时,有少量液体溅出
C.定容时仰视刻度线
D.定容后倒置摇匀后再正立时,发现液面低于刻度线.
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)先计算出浓硫酸的物质的量浓度,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;
(3)浓硫酸密度大于水的密度,浓硫酸稀释过程中放出大量的热,应该将浓硫酸缓缓加入水中,顺序不能颠倒;
(4)根据c=并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
(2)先计算出浓硫酸的物质的量浓度,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;
(3)浓硫酸密度大于水的密度,浓硫酸稀释过程中放出大量的热,应该将浓硫酸缓缓加入水中,顺序不能颠倒;
(4)根据c=并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答:
解:(1)操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有500mL容量瓶,
故答案为:500mL容量瓶;
(2)浓硫酸的物质的量浓度为c=
=
=18.4mol/L,设所需浓硫酸的体积为VmL,
根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×VmL=0.5mol/L×500mL
解得V=13.6mL,
故答案为:13.6;
(3)稀释浓硫酸时应将浓硫酸沿器壁慢慢加入到水中,并不断搅拌,操作方法为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌,
故答案为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌;
(4)A.用量筒量取浓硫酸时,仰视量筒的刻度,则所取的浓硫酸的体积偏大,则所配溶液的浓度偏大,故A选;
B.向容量瓶中转移时,有少量液体溅出,会导致溶质的损失,则浓度偏小,故B不选;
C.定容时仰视刻度线,则溶液体积偏大,则浓度偏小,故C不选;
D.定容后倒置摇匀后再正立时,发现液面低于刻度线是正常的,对浓度无影响,故D不选.
故选A.
故答案为:500mL容量瓶;
(2)浓硫酸的物质的量浓度为c=
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |
根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×VmL=0.5mol/L×500mL
解得V=13.6mL,
故答案为:13.6;
(3)稀释浓硫酸时应将浓硫酸沿器壁慢慢加入到水中,并不断搅拌,操作方法为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌,
故答案为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌;
(4)A.用量筒量取浓硫酸时,仰视量筒的刻度,则所取的浓硫酸的体积偏大,则所配溶液的浓度偏大,故A选;
B.向容量瓶中转移时,有少量液体溅出,会导致溶质的损失,则浓度偏小,故B不选;
C.定容时仰视刻度线,则溶液体积偏大,则浓度偏小,故C不选;
D.定容后倒置摇匀后再正立时,发现液面低于刻度线是正常的,对浓度无影响,故D不选.
故选A.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
| A、地下钢管连接镁块 |
| B、金属护拦表面涂漆 |
| C、枪炮表面涂上一层油 |
| D、水中的钢闸门连接电源的负极 |
A与B在容积为1L的密闭容器中发生反应:aA(s)+bB(g)?cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:下列说法正确的是( )
| n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min |
| 0.12 | 0.06 | 0.10 | t1 |
| 0.06 | 0.12 | 0.20 | t2 |
A、0~t1时间段内,平均反应速率v(B)=
| ||
B、若起始时n(D)=0,则t2时v(D)=
| ||
| C、升高温度,v(B)、vC)、v(D)均增大 | ||
| D、b:d=6:1 |
在一恒容真空密闭容器,通入2molPCl3和2molCl2,加热到200℃时发生了反应:PCl5(g)?PCl3(g)+Cl2(g),达到平衡时,PCl5有0.4mol,如果此时移走1molPCl3和1molCl2,再次达到平衡时PCl5的物质的量是( )
| A、小于0.2mol |
| B、0.2mol |
| C、0.4mol |
| D、0.2mol和0.4mol之间 |
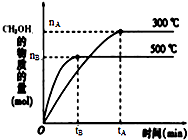 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.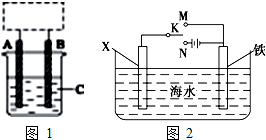 I.某学生设计了如图1所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4=H2↑+CuSO4,试回答:
I.某学生设计了如图1所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4=H2↑+CuSO4,试回答: