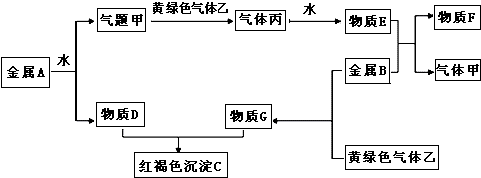
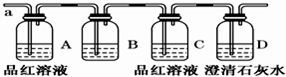
题目内容
在等物质的量浓度的两种弱酸的钠盐(NaR、NaR′)溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO3,2NaR′+CO2+H2O=2HR′+Na2CO3.现有物质的量浓度相同的四种溶液:①HR②HR′③NaR④NaR′,由水电离出c(OH-)大小顺序是( )
| A、①>②>③>④ |
| B、②>①>④>③ |
| C、③>④>①>② |
| D、④>③>②>① |
考点:离子浓度大小的比较
专题:
分析:根据强酸制取弱酸知,等物质的量浓度的两种弱酸的钠盐(NaR、NaR′)溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO3,说明HR的酸性小于碳酸而大于碳酸氢根离子;2NaR′+CO2+H2O═2HR′+Na2CO3,说明HR′的酸性小于碳酸氢根离子,所以酸性HR>HR′;酸溶液抑制了水的电离,酸性越强,水的电离程度越小;强碱弱酸盐溶液中,酸根离子对应的酸越强,水解程度越小,则电离的氢氧根离子越小,据此判断四种溶液中水电离出c(OH-)大小.
解答:
解:NaR′的反应:CO2先和水反应生成H2CO3,然后和NaR′发生第一步反应:NaR′+H2CO3=NaHCO3+HR′,由于NaR′过量,所以NaHCO3继续和NaR'反应:NaHCO3+NaR′=HR′+Na2CO3,总反应表示为:2NaR’+CO2+H2O=2HR′+Na2CO3,酸性:H2CO3>HCO3->HR′,
NaR的反应:CO2先和水反应生成H2CO3,然后和NaR发生第一步反应:NaR+H2CO3=NaHCO3+HR,虽然NaR过量,但反应停在了NaR+CO2+H2O=HR+NaHCO3这步,说明酸性:H2CO3>HR>HCO3-,所以酸性:HR>HR′,
①HR和②HR为酸,酸溶液中氢离子抑制了水的电离,且酸性越强,水的电离程度越小,由于酸性HR>HR′,则水电离的氢氧根离子浓度:①<②<10-7mol/L;
③NaR和④NaR′为盐溶液,酸根离子的水解促进了水的电离,酸根离子对应的酸的酸性越强,酸根离子水解程度越小,则水解程度:③<④,则溶液中水电离的氢氧根离子浓度:10-7mol/L<③<④,
根据以上分析可知,物质的量浓度相同的四种溶液:①HR②HR′③NaR④NaR′,由水电离出c(OH-)大小顺序:④>③>②>①,
故选D.
NaR的反应:CO2先和水反应生成H2CO3,然后和NaR发生第一步反应:NaR+H2CO3=NaHCO3+HR,虽然NaR过量,但反应停在了NaR+CO2+H2O=HR+NaHCO3这步,说明酸性:H2CO3>HR>HCO3-,所以酸性:HR>HR′,
①HR和②HR为酸,酸溶液中氢离子抑制了水的电离,且酸性越强,水的电离程度越小,由于酸性HR>HR′,则水电离的氢氧根离子浓度:①<②<10-7mol/L;
③NaR和④NaR′为盐溶液,酸根离子的水解促进了水的电离,酸根离子对应的酸的酸性越强,酸根离子水解程度越小,则水解程度:③<④,则溶液中水电离的氢氧根离子浓度:10-7mol/L<③<④,
根据以上分析可知,物质的量浓度相同的四种溶液:①HR②HR′③NaR④NaR′,由水电离出c(OH-)大小顺序:④>③>②>①,
故选D.
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响因素为解答关键,注意掌握酸溶液抑制了水的电离、能够水解的盐溶液促进了水的电离,试题侧重考查学生的分析、理解能力及灵活应用所学知识都能力.

练习册系列答案
相关题目
在一恒容真空密闭容器,通入2molPCl3和2molCl2,加热到200℃时发生了反应:PCl5(g)?PCl3(g)+Cl2(g),达到平衡时,PCl5有0.4mol,如果此时移走1molPCl3和1molCl2,再次达到平衡时PCl5的物质的量是( )
| A、小于0.2mol |
| B、0.2mol |
| C、0.4mol |
| D、0.2mol和0.4mol之间 |
下列有关溶度积常数Ksp的说法正确的是( )
| A、常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小 |
| B、溶度积常数Ksp只受温度影响,温度升高Ksp减小 |
| C、溶度积常数Ksp只受温度影响,温度升高Ksp增大 |
| D、常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变 |

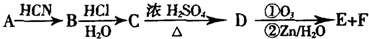
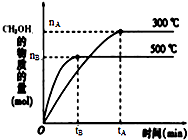 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.