题目内容
关于原电池、电解池的电极名称,下列说法错误的是( )
| A、原电池中失去电子的一极为负极 |
| B、电解池中与直流电源负极相连的一极为阴极 |
| C、原电池中相对活泼的一极为正极 |
| D、电解池中发生氧化反应的一极为阳极 |
考点:原电池和电解池的工作原理
专题:
分析:原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,所以较活泼的金属作负极,较不活泼的电极为正极,电子从负极沿导线流向正极.而电解池的电极与电源有关,与电源正极相连的为阳极,与电源负极相连的为阴极,以此来解答.
解答:
解:A.原电池中负极失去电子,则失去电子的一极为负极,故A正确;
B.电解池中与电源的连接决定阴极或阳极,则电解池中与直流电源负极相连的一极为阴极,故B正确;
C.一般来说,原电池中相对活泼的一极失去电子,为原电池的负极,故C错误;
D.与电源正极相连的为阳极,得到电子,发生氧化反应,故D正确;
故选C.
B.电解池中与电源的连接决定阴极或阳极,则电解池中与直流电源负极相连的一极为阴极,故B正确;
C.一般来说,原电池中相对活泼的一极失去电子,为原电池的负极,故C错误;
D.与电源正极相连的为阳极,得到电子,发生氧化反应,故D正确;
故选C.
点评:本题考查电化学反应原理,为高频考点,把握正负极、阴阳极的判断方法为解答本题关键,注意原电池及电解池的区别,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
在25℃时,物质的浓度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其对应溶液pH分别为a、b、c(单位为mol?L-1),下列判断正确的是( )
| A、a=b=c |
| B、A=b>c |
| C、b>a>c |
| D、c>a>b |
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法.流程如下:CrO
Cr2O
Cr3+
Cr(OH)3↓,其中第①步中存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O.下列有关说法正确的是( )
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| fe2+ |
| ②还原 |
| 沉淀剂a |
| ③沉淀 |
| A、第①步当2c (Cr2O72-)=c(CrO42-)时,达到了平衡状态 |
| B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C、Cr(OH)3是一种两性氢氧化物,所以像Al(OH)3一样能溶于氨水和碳酸溶液中 |
| D、第②步中,还原0.1 mol Cr2O72-需要91.2 g FeSO4 |
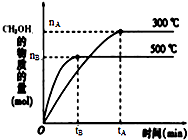 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
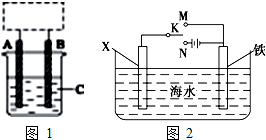 I.某学生设计了如图1所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4=H2↑+CuSO4,试回答:
I.某学生设计了如图1所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4=H2↑+CuSO4,试回答: