题目内容
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示.
①b>f ②915℃,2.0MPa时E的转化率为60%
③该反应的△S>0 ④K(1000℃)>K(810℃).
上述①~④中正确的有( )
①b>f ②915℃,2.0MPa时E的转化率为60%
③该反应的△S>0 ④K(1000℃)>K(810℃).
上述①~④中正确的有( )
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、4个 | B、3个 | C、2个 | D、1个 |
考点:化学平衡的计算
专题:
分析:同温下,增大压强,平衡逆向进行,平衡时G的体积分数变小,故可知c>75.0>54.0>a>b,利用c>75.0>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,从而可知f>75.0,所以①正确;在915℃、2M Pa下,设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得
×100%=75%,解得x=0.6,②正确;该题是气体体积增大的反应,因此为熵增反应,③正确;结合前面分析知升温平衡正向移动,则平衡常数增大,④正确,
| 2ax |
| a-ax+2ax |
解答:
解:①利用图表分析结合平衡原理分析;a与b、c与d、e与f之间是压强问题,随着压强增大,平衡逆向移动,G的体积分数减小,b<a;c>75%,e>83%;c、e是温度问题,随着温度升高,G的体积分数增大,所以正反应是一个吸热反应,所以,K(1000℃)>K(810℃);f的温度比b的高,压强比b的小,所以f>b,故①错误;
②设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得
×100%=75%,解得x=0.6,α=60%,故②正确;
③该反应是一个气体分子增大的反应,属于熵增反应,故③正确;
④c、e是温度问题,随着温度升高,G的体积分数增大,所以正反应是一个吸热反应,所以,K(1000℃)>K(810℃),故④正确;
故选B.
②设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得
| 2ax |
| a-ax+2ax |
③该反应是一个气体分子增大的反应,属于熵增反应,故③正确;
④c、e是温度问题,随着温度升高,G的体积分数增大,所以正反应是一个吸热反应,所以,K(1000℃)>K(810℃),故④正确;
故选B.
点评:本题考查化学平衡影响因素分析,数据处理的方法应用,平衡计算和对比判断是解题关键,题目难度中等.

练习册系列答案
相关题目
精确配制一定物质的量浓度的NaOH溶液,下面实验操作中,正确的是( )
| A、称量时,将NaOH固体直接放在天平托盘上面的纸上 |
| B、将称好的NaOH固体直接放入容量瓶中,加入少量水溶解 |
| C、在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中 |
| D、将烧杯中已冷却的NaOH溶液注入容量瓶中 |
下列各组物质中,物质之间不可能实现如下转化的是:X
Y
Z.( )
| M |
| M |
| 选 项 | X | Y | Z | M |
| A | NH3 | NO | NO2 | O2 |
| B | NaOH | Na2SO3 | NaHSO3 | SO2 |
| C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
| D | Mg | C | CO | CO2 |
| A、A | B、B | C、C | D、D |
下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
| A、地下钢管连接镁块 |
| B、金属护拦表面涂漆 |
| C、枪炮表面涂上一层油 |
| D、水中的钢闸门连接电源的负极 |

 )的结构可简写为
)的结构可简写为 ,则E的分子式是
,则E的分子式是
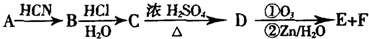
 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.