题目内容
18.下列有关氯化钠晶体(图为晶胞)的叙述中,正确的是( )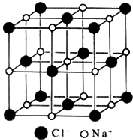
| A. | 在NaCl晶体中,每个Na+周围与其距离最近的Na+有6个 | |
| B. | 氯离子采取A2密堆积,钠离子填入八面体空隙中 | |
| C. | 每个晶胞含2个Na+和2个Cl- | |
| D. | 氯化钠的化学式为NaCl |
分析 A.在氯化钠晶体中,每个钠离子周围与它最近且距离相等的Na+有12个;
B.氯离子在正八面体的中心的话,钠离子在六个顶点;
C.根据均摊法计算,钠离子在棱上和体心,氯离子在顶点和面心;
D.根据均摊法算出的钠离子和氯离子数计算.
解答 解:A.在NaCl晶体中,每个Na+周围与它最近且距离相等的Na+有3×8×$\frac{1}{2}$=12,故A错误;
B.氯离子在正八面体的中心的话,钠离子在六个顶点,故B错误;
C.氯化钠晶体中,钠离子在棱上和体心,含有钠离子的个数为12×$\frac{1}{4}$+1=4,离子在体心,氯离子在顶点和面心,含有氯离子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故C错误;
D.根据C的计算结果,氯化钠的化学式为NaCl,故D正确.
故选D.
点评 本题考查晶胞分析,注意把握NaCl的晶体结构、离子占据的位置是解答的关键,学生具有较好的空间想象能力即可解答,题目难度中等.

练习册系列答案
相关题目
8.体积相同、PH也相同的H2SO4溶液和HCl溶液,分别与NaOH溶液中和反应时两者消耗NaOH的物质的量( )
| A. | 相同 | B. | H2SO4溶液消耗的NaOH多 | ||
| C. | HCl溶液消耗的NaOH多 | D. | 无法比较 |
6.对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol•L-1,则理论上最多能溶解铜的物质的量为( )
| A. | 0.80 mol | B. | 0.72 mol | C. | 0.45 mol | D. | 0.40 mol |
13.下列说法错误的是( )
| A. | 石油里含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含有C18以上的烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 石油的分馏是一个物理过程,而裂化及裂解属于化学过程 | |
| D. | 石油裂解的惟一目的是获得乙烯 |
3.下列各组微粒中,不能形成配位键的是( )
| A. | Cu2+、H2O | B. | Ag+、NH4+ | C. | Zn2+、NH3 | D. | Fe3+、SCN- |
7.某烃的结构简式是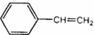 ,它不可能具有的性质是( )
,它不可能具有的性质是( )
 ,它不可能具有的性质是( )
,它不可能具有的性质是( )| A. | 既能使溴水褪色,也能使酸性KMnO4溶液褪色 | |
| B. | 易溶于水和有机溶剂 | |
| C. | 能与H2在一定条件下发生反应 | |
| D. | 能发生加聚反应,生成物可用 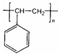 表示 表示 |
8. 向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
 向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )| 序号 | 甲 | 乙 |
| A | 镁条 | 稀硫酸 |
| B | 硫酸铁溶液 | 氢氧化钠溶液 |
| C | 硝酸钡溶液 | 硫酸钠溶液 |
| D | 生锈的铁钉 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |

 .
.