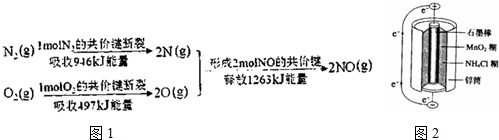
题目内容
3.下列各组微粒中,不能形成配位键的是( )| A. | Cu2+、H2O | B. | Ag+、NH4+ | C. | Zn2+、NH3 | D. | Fe3+、SCN- |
分析 含有空轨道的离子和含有孤电子对的原子或离子能形成配位键,据此分析解答.
解答 解:A.铜离子含有空轨道,H2O中O原子有孤电子对,所以能形成配位键,故A不选;
B.Ag+含有空轨道,但是NH4+中N原子的最外层电子全部为成键电子,没有孤电子对,所以不能形成配位键,故B选;
C.Zn2+含有空轨道,NH3中N原子有孤电子对,所以能形成配位键,故C不选;
D.Fe3+与SCN-,能形成配合物Fe(SCN)3,所以能形成配位键,故D不选;
故选B.
点评 本题考查了配位键,明确配位键的构成条件是解本题关键,难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
14.手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,下图是利用手持技术得到的微粒物质的量变化图,常温下向20ml0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.下列说法正确的是( )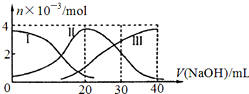

| A. | H2 A在水中的电离方程式是:H2A=H ++HA -;HA -═H++A2- | |
| B. | 当V(NaOH)=20mL时,则有:c(Na + )>c(HA- )>c(H + )>c(A 2- )>c(OH- ) | |
| C. | 当V(NaOH)=30mL时,则有:2c(H + )+c(HA- )+2c(H2A)=c(A 2- )+2 c(OH- ) | |
| D. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 |
18.下列有关氯化钠晶体(图为晶胞)的叙述中,正确的是( )
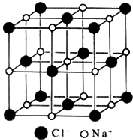

| A. | 在NaCl晶体中,每个Na+周围与其距离最近的Na+有6个 | |
| B. | 氯离子采取A2密堆积,钠离子填入八面体空隙中 | |
| C. | 每个晶胞含2个Na+和2个Cl- | |
| D. | 氯化钠的化学式为NaCl |
13.下列离子方程式书写正确的是( )
| A. | 向CuSO4溶液中加入钠:2Na+Cu2+=Cu+2Na+ | |
| B. | 向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH-=2H2O+BaCl2 | |
| C. | 澄清石灰水与盐酸反应:H++OH-=H2O | |
| D. | Na2O2与水发生反应:2O22-+2 H2O=4 OH-+O2↑ |
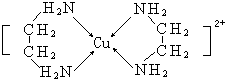
 、
、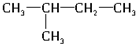 .
.