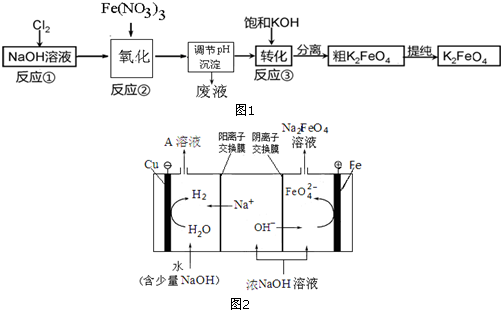
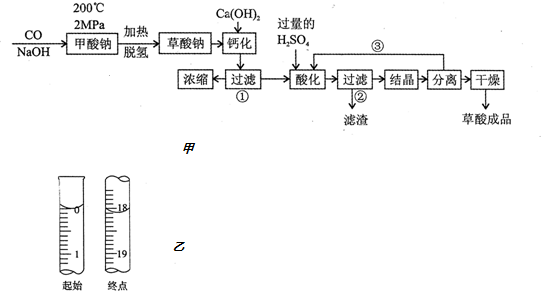
题目内容
2.+3价Co的配合物CoClm•nNH3,中心原子的配位数为6,若1mol该配合物与足量AgNO3溶液反应生成1molAgCl沉淀,用配合物形式写出该配合物的化学式[CoCl2(NH3)4]Cl.分析 配合物也叫络合物,为一类具有特征化学结构的化合物,配合物CoClm•nNH3,配合物中配位离子Cl-不与Ag+反应,Co显示+3价,配合物、NH3显电中性,即配合物中,含有3个Cl-,1mol该配合物生成1mol AgCl沉淀,据此计算出外界离子Cl-离子的数目判断,根据中心原子的配位数为6分析n的值,据此分析解答.
解答 解:Co显示+3价,配合物、NH3显电中性,即配合物中,含有3个Cl-,1mol该配合物生成1mol AgCl沉淀,则1mol该配合物中含1mol外界离子Cl-,即配离子中含有2个Cl-,又由于Co3+配位数为6,则NH3配位数为4,故该配合物的化学式可写为:[CoCl2(NH3)4]Cl,
故答案为:[CoCl2(NH3)4]Cl.
点评 本题主要考查了配合物的组成,电离时外界电离,内界不电离是解题的关键,题目难度不大.

练习册系列答案
相关题目
13.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,HAt极不稳定 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
10.NA代表阿伏加德罗常数,下列说法中正确的是( )
| A. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| B. | 1L0.1 mol/L的NH4NO3溶液中氮原子数小于0.2NA | |
| C. | 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH- | |
| D. | 含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
17.下列排列顺序正确的是( )
| A. | 还原性:F->Cl->Br->I- | |
| B. | 酸性:碳酸>石碳酸>碳酸氢钠>氢氧化铝 | |
| C. | 氧化性:Na>S>F2>O2 | |
| D. | NaHCO3溶液:c(HCO3-)>c(CO32-)>c(OH-) |
14.下列溶液中各微粒的浓度关系正确的是( )
| A. | 常温下,等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+) | |
| B. | 常温时向NH4HSO4溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)=c(SO42-) | |
| C. | AgCl的Ksp=1.8×10-10 mol2•L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2•L-2 | |
| D. | 将10 mL 0.1 mol/L Na2SO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中:c(Na+)>c(Cl-)>c(HSO3-)>c(SO32-) |
12.在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g)?2HI(g).已知起始时加入1mol H2和1mol I2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
| A. | 2 mol HI(g) | B. | 2 mol H2(g)和1 mol I2(g) | ||
| C. | 1 mol H2(g)和2 mol I2(g) | D. | 1 mol I2(g)和2 mol HI(g) |