题目内容
20.(1)一定条件下,向容积为2L的恒容密闭容器中充入1mol CH3OH(g)和3mol H2O(g),CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H(298K)=+49.4kJ/mol.实验测得:达到平衡状态时,吸收热量19.76kJ.则①达平衡时混合气体的压强是反应前的1.2倍.
②该条件下反应达平衡状态的依据是(填序号)D.
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热Q kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-32QkJ•mol-1.
(3)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
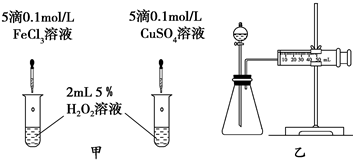
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阳离子相同,排除阴离子的干扰.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.检查该装置气密性的方法是关闭分液漏斗活塞,将注射器活塞向外拉出一定距离,一段时间后松开,观察活塞是否回到原位,实验中需要测量的数据是收集40mL气体所需时间.
分析 (1)①恒温恒容下,气体的压强之比等于物质的量之比;
②平衡状态时正逆反应速率相等,各组分的浓度保持不变;
(2)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;(3)①根据反应生成气体的快慢分析;根据H2O2分解的催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阳离子相同,更为合理;根据反应物、生成物、反应条件写出反应方程式.
②根据乙图装置来选择气密性的检查方法;该反应是通过反应速率分析的,所以根据v=$\frac{△c}{△t}$来判断.
解答 解:(1)①吸热19.76KJ,据方程式可以求得,反应的甲醇有$\frac{19.76KJ}{49.4KJ/mol}$=0.4mol,则
CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H(298K)=+49.4kJ/mol
反应前(mol) 1 3 0 0
反应了(mol) 0.4 0.4 0.4 1.2
平衡后(mol) 0.6 2.6 0.4 1.2
平衡后,混合气体的压强是原来的$\frac{0.6+2.6+0.4+1.2}{1+3}$=1.2,
故答案为:1.2;
②A、不能体现正逆反应速率相等,故A错误;
B、体积不变,反应物和生成物都是气体,所以密度永远不变,故B错误;
C、甲醇和水蒸气浓度相等,决定于加入的量,与是否平衡无关,故C错误;
D、反应前后气体体积不同,所以气体总物质的量不变说明正逆反应速率相等,反应达到平衡状态,故D正确;
故选D;
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热QkJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为32QKJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-32QkJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-32QkJ•mol-1;
(3)①该反应中产生气体,而且反应放热,所以可根据反应产生气泡快慢或反应完成的先后或试管壁的冷热程度来判断;H2O2分解的催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,这样可以控制阴离子相同,排除阴离子的干扰,更为合理;故答案为:反应产生气泡的快慢; 控制阳离子相同,排除阴离子的干扰;
②结合乙图装置,该气密性的检查方法为:关闭分液漏斗活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;反应是通过反应速率分析的,根据v=$\frac{△c}{△t}$,所以,实验中需要测量的数据是时间(或收集一定体积的气体所需要的时间),
故答案为:关闭分液漏斗活塞,将注射器活塞向外拉出一定距离,一段时间后松开,观察活塞是否回到原位;收集40mL气体所需时间.
点评 本题主要考查了催化剂的作用及化学反应速率的影响因素等知识点,难度不大,要会分析将FeCl3改为Fe2(SO4)3更为合理的理由.

 阅读快车系列答案
阅读快车系列答案| A. | 2 mol•L-1 | B. | 1 mol•L-1 | C. | 0.67 mol•L-1 | D. | 0.55 mol•L-1 |
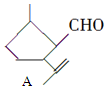 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加溴水,再加KMnO4酸性溶液 | |
| B. | 先加入足量的新制Cu(OH)2悬浊液,微热,酸化后再加溴水 | |
| C. | 先加银氨溶液,微热,再加溴水 | |
| D. | 先加KMnO4酸性溶液,再加银氨溶液,微热 |
| A. | 16g | B. | 32 | C. | 64g/mol | D. | 32g/mol |
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
| A. | 480mL,56.2g | B. | 500mL,56.2g | C. | 500mL,58.5g | D. | 任意规格,56.2g |
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| B. | 在溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀,证明原溶液中有Fe2+ | |
| C. | 向FeCl3溶液中滴加稀氨水,可制备Fe(OH)3胶体 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发、灼烧}{→}$无水FeCl3 |
 元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、[Cu(NH3)4]2+(深蓝色)等形式存在.CuCl为难溶于水的白色固体.回答下列问题:
元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、[Cu(NH3)4]2+(深蓝色)等形式存在.CuCl为难溶于水的白色固体.回答下列问题: