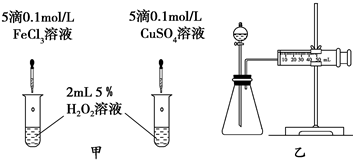
题目内容
10.将50mL 0.1mol•L-1的NaCl溶液和50mL 0.5mol•L-1的CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为( )| A. | 2 mol•L-1 | B. | 1 mol•L-1 | C. | 0.67 mol•L-1 | D. | 0.55 mol•L-1 |
分析 先分别利用n=cV来计算溶液中溶质的物质的量,从而确定Cl-的物质的量,最后利用c=$\frac{n}{V}$来计算混合液中Cl-的物质的量浓度.
解答 解:NaCl的物质的量为0.05L×0.1mol/L=0.005mol,
CaCl2的物质的量为0.05L×0.5mol/L=0.025mol,
则Cl-的物质的量为0.005mol+0.025mol×2=0.055mol,
混合溶液的体积为0.05L+0.05L=0.1L,
则混合液中Cl-的物质的量浓度为$\frac{0.055mol}{0.1L}$=0.55mol/L,
故选D.
点评 本题考查混合溶液中离子浓度的计算,明确物质的量、体积、浓度的关系即可解答,并注意溶液体积的变化忽略不计来分析解答.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
13.下列说法正确的是( )
| A. | 用溴的四氯化碳溶液可除去甲烷中的乙烯 | |
| B. | 乙烯和苯均能使酸性高锰酸钾溶液褪色 | |
| C. | 苯在空气中燃烧时冒浓烟,说明苯组成中含碳量较高 | |
| D. | 间二甲苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 |
1.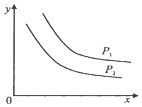 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | a+1<b |
18.下列设计的实验方案不能达到实验目的是( )
| A. | 提纯混有少量硝酸钾的氯化钠采用蒸发结晶,趁热过滤的方法 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入适量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象 | |
| D. | 用KI滴定FeCl3溶液时选用淀粉作指示剂 |
5.关于如图所示①、②两个装置的叙述中,正确的是( )
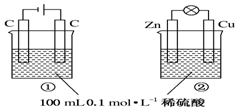

| A. | 硫酸浓度变化:①增大,②减小 | |
| B. | 装置名称:①是原电池,②是电解池 | |
| C. | 电极反应式:①中阳极:4OH--4e-═2H2O+O2↑②中正极:Zn-2e-═Zn2+ | |
| D. | 离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动 |
15.下列关于物质的量的表述中不正确的是( )
| A. | 1.5 mol H2O和2.5 mol水 | B. | 2 mol H2SO4 和 5 mol硫酸 | ||
| C. | 1.2 mol H2 和1.6 mol 氢 | D. | 10 mol Ne 和 12mol 氖原子 |
19.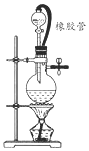 在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
 在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )| A. | 防止氯气造成大气污染 | |
| B. | 使反应的氯气循环使用 | |
| C. | 使烧瓶内的压强与大气压保持一致 | |
| D. | 使分液漏斗中的液体更容易注入烧瓶 |