题目内容
18.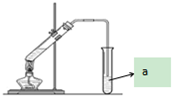 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:(1)实验室制取乙酸乙酯的方程式为:
 ,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;
,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;(2)左侧试管中所加试剂是乙醇,浓硫酸,乙酸(按加药顺序填写);
(3)加热时常需向左侧大试管中加入沸石的原因是防止暴沸;
(4)①为从上述实验后的混合气体中分离出乙酸乙酯,右侧试管中所选用的试剂a是饱和碳酸钠溶液,a试剂的作用是BC(填字母);
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
②右侧试管中导气管能否伸入液面之下?不能(填“能”或“不能”),原因是防止倒吸;
③要从用a吸收后的混合物之中分离出乙酸乙酯,方法是分液,原因是乙酸乙酯难(填“易”或“难”)溶于水.
分析 (1)实验室用乙酸和乙醇反应制取乙酸乙酯,依据酯化反应的反应历程是羧酸脱羟基醇脱氢书写;浓硫酸的作用是催化剂和吸水剂;
(2)醋酸易挥发,乙醇的密度比浓硫酸的小,类比浓硫酸的稀释进行解答;
(3)加入沸石的原因是防止暴沸;
(4)①饱和碳酸钠降低了乙酸乙酯的溶解度,同时还能除去混有的乙醇和乙酸;
②根据导管伸入液面下可能发生倒吸分析;
③分离互不相溶的液体的操作是分液.
解答 解:(1)实验室用乙酸和乙醇反应制取乙酸乙酯,发生反应的方程式为: ,反应类型为取代反应,浓硫酸的作用是催化剂和吸水剂;
,反应类型为取代反应,浓硫酸的作用是催化剂和吸水剂;
故答案为: ;取代反应;催化剂和吸水剂;
;取代反应;催化剂和吸水剂;
(2)浓硫酸的稀释是将浓硫酸加入水中,边加边搅拌,迁移到此处,即先在大试管中加入乙醇,然后慢慢向其中注入硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸,故答案为:乙醇,浓硫酸,乙酸;
(3)加入沸石的原因是防止暴沸,故答案为:防止暴沸;
(4)①制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,产物便于分层,
故答案为:饱和碳酸钠溶液;BC;
②导管不能插入溶液中,防止饱和碳酸钠溶液吸入反应试管中,故答案为:不能;防止倒吸;
③乙酸乙酯难溶于水,可以采用分液操作,分离乙酸乙酯;
故答案为:分液;难.
点评 本题考查乙酸乙酯的制备,题目难度中等,涉及的题量较大,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
相关题目
9.关于下列四个图象的说法不正确的是( )
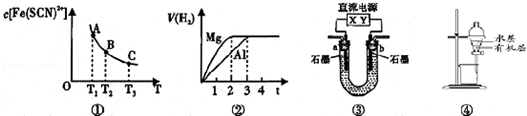

| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)中的c[Fe(SCN)2+]与温度T的平衡图象,A点与B点相比,A点的c(Fe3+)更小 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③直流电源Y极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-═O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
13.化学键的键能是指气态原子间形成1mol化学键时释放的能量,也可以理解为破坏l mol化学键需要吸收的热量.如表中为一些键能数据(单位:kJ•mol-1)
结合上表中数据回答下列问题:
(1)写出氢气在氯气中燃烧的热化学方程式:H2(g)+C12(g)=2HC1(g)△H=-183 kJ•mol-l.
(2)已知2H2(g)+S2(s)=2H2S(g)△H=-224.5kJ•mol-1和表中数值可计算出l mol S2(s)气化时将吸收 (填“吸收”或“放出”)4.5 kJ的热量.
(3)通过表来预测卤代烃RX在同样条件下发生碱性水解反应时,RF、RC1、RBr、RI(R相同)的反应活性由大到小的顺序是RI>RBr>RC1>RF.
(4)H2分别与O2(g)、S(s)、Se(s)、Te(s)单质反应生成1mol气态氢化物的反应热如下:
a.+99.7kJ•mol-1 b.+29.7kJ•mol-1 c.-20.6kJ•mol-1 d.-241.8kJ•mol-1
①表示生成1mol碲化氢反应热的是a(填字母代号).
②O=O的键能为500.4 kJ•mol-l.
③写出硫化氢气体与氧气反应生成固态硫和气态水的热化学方程式2H2S(g)+O2(g)=S2(s)+2H2O(g)△H=-259.1 kJ•mol-l.
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| H-H | 436 | C-F | 427 | H-S | 339 |
| S=S | 255 | C-C1 | 330 | H-F | 565 |
| C1-C1 | 243 | C-I | 218 | H-C1 | 431 |
| O=O | ? | H-O | 464 | H-Br | 366 |
(1)写出氢气在氯气中燃烧的热化学方程式:H2(g)+C12(g)=2HC1(g)△H=-183 kJ•mol-l.
(2)已知2H2(g)+S2(s)=2H2S(g)△H=-224.5kJ•mol-1和表中数值可计算出l mol S2(s)气化时将吸收 (填“吸收”或“放出”)4.5 kJ的热量.
(3)通过表来预测卤代烃RX在同样条件下发生碱性水解反应时,RF、RC1、RBr、RI(R相同)的反应活性由大到小的顺序是RI>RBr>RC1>RF.
(4)H2分别与O2(g)、S(s)、Se(s)、Te(s)单质反应生成1mol气态氢化物的反应热如下:
a.+99.7kJ•mol-1 b.+29.7kJ•mol-1 c.-20.6kJ•mol-1 d.-241.8kJ•mol-1
①表示生成1mol碲化氢反应热的是a(填字母代号).
②O=O的键能为500.4 kJ•mol-l.
③写出硫化氢气体与氧气反应生成固态硫和气态水的热化学方程式2H2S(g)+O2(g)=S2(s)+2H2O(g)△H=-259.1 kJ•mol-l.
10.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K=$\frac{c({H}_{2}C(CO))}{C({H}_{2}O)}$,它所对应的化学方程式为:C(s)+H2O(g)?CO(g)+H2(g)
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正=V(N2)逆(填:>、<、=、不能确定).
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是a(填序号)
a.缩小体积增大压强 b.升高温度 c.加催化剂 d.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g)+3B(g)?2C(g)+D(s)△H,其化学平衡常数K与温度t的关系如下表:
请完成下列问题:
①判断该反应的△H>0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是cd(填序号).
a.3v(B)(正)=2v(C)(逆)b.A和B的转化率相等
c.容器内压强保持不变 d.混合气体的密度保持不变.
(1)已知某反应的平衡表达式为:K=$\frac{c({H}_{2}C(CO))}{C({H}_{2}O)}$,它所对应的化学方程式为:C(s)+H2O(g)?CO(g)+H2(g)
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正=V(N2)逆(填:>、<、=、不能确定).
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是a(填序号)
a.缩小体积增大压强 b.升高温度 c.加催化剂 d.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g)+3B(g)?2C(g)+D(s)△H,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol•L-1)2 | 4×106 | 8×107 | K1 | … |
①判断该反应的△H>0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是cd(填序号).
a.3v(B)(正)=2v(C)(逆)b.A和B的转化率相等
c.容器内压强保持不变 d.混合气体的密度保持不变.
7.对下列符号意义的表述正确的是( )
| A. | N2:两个氮原子 | B. | 2H:两个氢元素 | ||
| C. | 2H2O:两个水分子 | D. | Ca2+:钙元素的化合价为+2价 |
8.我国“长征二号”火箭的主要燃料是偏二甲肼(用R表示),在火箭发射时,偏二甲肼与四氧化二氮剧烈反应,产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4═3N2+4H2O+2CO2,下列说法错误的是( )
| A. | 此反应是氧化还原反应 | |
| B. | N2O4在反应中作还原剂 | |
| C. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| D. | R的分子式为C2H8N2 |
 .
.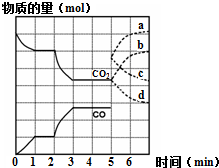 有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.
有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.