题目内容
7.对下列符号意义的表述正确的是( )| A. | N2:两个氮原子 | B. | 2H:两个氢元素 | ||
| C. | 2H2O:两个水分子 | D. | Ca2+:钙元素的化合价为+2价 |
分析 A.2N可表示2个N原子;
B.2H表示2个H原子;
C.化学式前面的系数表示分子个数;
D.Ca2+为离子符号.
解答 解:A.2N可表示2个N原子,N2可表示氮气或1个氮气分子或1个分子由2个N原子构成,故A错误;
B.2H表示2个H原子,元素不能描述个数,故B错误;
C.化学式前面的系数表示分子个数,则2H2O表示两个水分子,故C正确;
D.Ca2+为离子符号,表示带2个单位的正电荷,元素的化合价在元素符号的正上方,故D错误;
故选C.
点评 本题考查化学用语,为高频考点,把握离子符合、分子、原子及化学式的意义为解答关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
2.若已知标准氢氧化钠溶液的浓度为0.2000mol/L,来测定未知浓度的盐酸溶液,实验步骤如下,请完成填空
(1)仪器的洗涤:将2支滴定管和锥形瓶洗涤干净,滴定管还要润洗.
(2)在滴定管中装入相应的溶液,并记录好初读数
(3)用滴定管量取20.00ml的未知盐酸溶液于锥形瓶中,并加入2到3滴酚酞试液作为指示剂,振荡,摇匀.
(4)滴定操作:滴定时一手控制滴定管,一手摇动锥形瓶,眼睛观察锥形瓶内颜色的变化,当溶液颜色由无色变为浅红色,且半分钟内不变色时,则达滴定终点,记录读数.
(5)数据处理
该同学要做第三次实验的理由是第二次实验误差较大.
以上数据计算待测盐酸的物质的量浓度为0.1849mol/L.
(1)仪器的洗涤:将2支滴定管和锥形瓶洗涤干净,滴定管还要润洗.
(2)在滴定管中装入相应的溶液,并记录好初读数
(3)用滴定管量取20.00ml的未知盐酸溶液于锥形瓶中,并加入2到3滴酚酞试液作为指示剂,振荡,摇匀.
(4)滴定操作:滴定时一手控制滴定管,一手摇动锥形瓶,眼睛观察锥形瓶内颜色的变化,当溶液颜色由无色变为浅红色,且半分钟内不变色时,则达滴定终点,记录读数.
(5)数据处理
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
以上数据计算待测盐酸的物质的量浓度为0.1849mol/L.
12.根据如图框图分析,下列说法不正确的是( )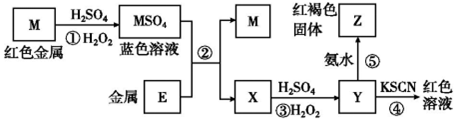

| A. | 在反应①中硫酸既表现了酸性、又表现了氧化性 | |
| B. | 我国是世界上最早使用反应②冶炼金属M的国家 | |
| C. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| D. | 红褐色固体Z不能溶于氢氧化钠溶液 |
19.能正确表示下列反应的离子方程式为( )
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | NaClO和NaOH的混合溶液中通入少量的SO2:ClO-+H2O+SO2=C1-+SO42-+2H+ | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
16.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1 mol/L氯化铜溶液中的Cu2+数小于NA | |
| B. | 标准状况下,22.4 L Cl2与水反应转移的电子数为NA | |
| C. | 28 g聚乙烯含有的碳原子数为2NA | |
| D. | 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L |
17.25℃时,在等体积的下列溶液中,发生电离的水的物质的量之比是( )
①0.5mol•L-1的H2SO4溶液,②0.05mol•L-1的Ba(OH)2溶液,③1mol•L-1的NaCl溶液,④纯水.
①0.5mol•L-1的H2SO4溶液,②0.05mol•L-1的Ba(OH)2溶液,③1mol•L-1的NaCl溶液,④纯水.
| A. | 107:107:1:1 | B. | 1:10:107:107 | C. | 107:106:2:2 | D. | 107:106:2×107:2 |
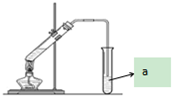 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: ,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;
,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;