题目内容
6.一定温度下,将2mol SO2气体和1mol O2气体通过一密闭容器中,发生如下反应:2SO2(g)+O2 (g)═2SO3(g).请填写下列空白:若容器体积固定为2L,反应1min时测得剩余1.2mol SO2,SO3的浓度为0.4mol/L.①1min内,O2的平均反应速率为0.2 mol•L-1•min-1;
②若反应经2min达到平衡,平衡时SO3的小于浓度0.8mol/L(填“大于”、“等于”或“小于”);
③改变起始物质加入的量,欲使反应达到平衡时SO3的物质的量分数与原平衡相等,起始加入的三种物质SO2、O2、SO3的物质的量a、b、c之间应满足的关系式;a+c=2,b+c/2=1.
分析 ①v=$\frac{△c}{△t}$,在化学反应方程式中,速率之比等于系数之比;
②达到平衡的过程,由于刚开始反应物浓度较大,因此开始反应速率较快,后逐渐减慢;
③改变起始物质加入的量,欲使反应达到平衡时某物质的物质的量分数与原平衡相等,则需达到等效平衡状态.
解答 解:①在1min中用SO3表示的反应速率v(SO3)=$\frac{△c(SO3)}{△t}$=$\frac{0.4mol•L-1}{1min}$=0.4 mol•L-1•min-1,所以v(O2)=0.5×0.4 mol•L-1•min-1=0.2 mol•L-1•min-1
故答案为:0.2 mol•L-1•min-1;
②后一分钟内速率小于前1min的反应速率,故后1min内SO3的浓度变化量小于0.4mol•L-1,故2分钟达到平衡,平衡时SO3的浓度小于0.8mol/L.
故答案为:小于;
③改变起始物质加入的量,欲使反应达到平衡时SO3的物质的量分数与原平衡相等,恒温恒容下,反应前后气体体积不相等,按化学计量数转化到左边满足n(SO2)=2mol,n(O2)=1mol,所以有a+c=2,b+$\frac{c}{2}$=1
故答案为:a+c=2;b+$\frac{c}{2}$=1.
点评 本题综合了化学反应速率以及平衡常数的知识,综合性比较强,难度较大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
13.一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内H2的反应速率为( )
| A. | 1.2mol/(L•min) | B. | 1.8 mol/(L•min) | C. | 0.6mol/(L•min) | D. | 2.4mol/(L•min) |
14.下表为元素周期表的一部分,请回答下列问题:
(1)③原子结构示意图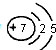 .
.
(2)⑥、⑦和⑧三种元素的最高价氧化物对应水化物酸性最强的是HClO4(填化学式)
(3)①和②元素的最高价氧化物对应水化物碱性最强是中NaOH(填化学式)
(4)⑧元素的单质与①元素的最高价氧化物对应水化物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | ④ | ⑤ | |||||
| 3 | ① | ② | ⑥ | ⑦ | ⑧ | |||
 .
.(2)⑥、⑦和⑧三种元素的最高价氧化物对应水化物酸性最强的是HClO4(填化学式)
(3)①和②元素的最高价氧化物对应水化物碱性最强是中NaOH(填化学式)
(4)⑧元素的单质与①元素的最高价氧化物对应水化物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
16.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1 mol/L氯化铜溶液中的Cu2+数小于NA | |
| B. | 标准状况下,22.4 L Cl2与水反应转移的电子数为NA | |
| C. | 28 g聚乙烯含有的碳原子数为2NA | |
| D. | 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L |
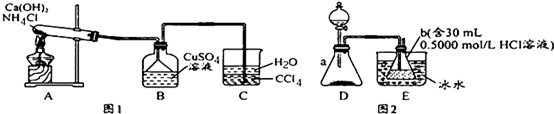
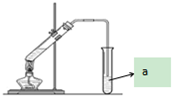 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: ,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;
,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;