题目内容
11.科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图.下列说法错误的是( )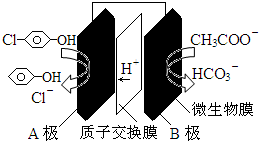
| A. | A极电极反应式为: +2e-+H+═ +2e-+H+═ +Cl- +Cl- | |
| B. | B极电极反应式为:CH3COO--8e-+4H2O═2HCO3-+9H+ | |
| C. | 溶液中的阴离子由A极向B极移动 | |
| D. | 该微生物电池在高温条件下无法正常工作 |
分析 原电池工作时,阳离子向正极移动,则A是正极,正极上发生得电子的还原反应: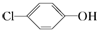 +2e-+H+═
+2e-+H+═ -OH+Cl-,B为负极,反应:CH3COO--8e-+4H2O═2HCO3-+9H+,以此解答该题.
-OH+Cl-,B为负极,反应:CH3COO--8e-+4H2O═2HCO3-+9H+,以此解答该题.
解答 解:A.A是正极,正极上发生得电子的还原反应: +2e-+H+═
+2e-+H+═ -OH+Cl-,故A正确;
-OH+Cl-,故A正确;
B.B为负极,负极上发生失电子的氧化反应:CH3COO--8e-+4H2O═2HCO3-+9H+,故B正确;
C.溶液中阴离子向负极移动,即阴离子向B极移动,但是由于交换膜为质子交换膜,所以A附近的阴离子不能透过交换膜向负极移动,故C错误;
D.微生物在高温下会失去活性,所以该微生物电池在高温条件下无法正常工作,故D正确.
故选C.
点评 本题考查新型电池,为高频考点,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此不能与酸溶液发生反应 |
2.判断NaHCO3白色粉末中混有Na2CO3的方法是( )
| A. | 加热,观察有无气体放出 | B. | 加入盐酸,观察有无气体放出 | ||
| C. | 加入澄清石灰水中观察有无沉淀 | D. | 加入CaCl2溶液观察有无沉淀 |
19.下列说法正确的是( )
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 点燃的镁条插入盛CO2的集气瓶中,迅速熄灭 | |
| C. | 铝在高温下能还原锰、铁、铬等金属氧化物 | |
| D. | 镁比铝活泼,更容易与NaOH溶液反应放出H2 |
16.下列各组物质混合后,不能生成氢氧化钠的是( )
| A. | 钠和水 | B. | 过氧化钠和水 | ||
| C. | 氢氧化钙溶液和碳酸钠溶液 | D. | 氢氧化钙溶液和氯化钠溶液 |
3.下列说法正确的是( )
| A. | △H<0,△S>0所有温度下反应能自发进行 | |
| B. | 化合反应都是放热反应,分解反应都是吸热反应 | |
| C. | 凡是放热反应都是自发的,吸热反应都是非自发性的 | |
| D. | 自发反应一定不需要任何条件就容易发生 |
20.一定温度下,对于可逆反应A(g)+2B(g)?3C(g)的下列叙述中,能说明反应已经达到平衡的是( )
| A. | 单位时间内消耗amolA,同时生成3amolC | |
| B. | 容器的压强不再变化 | |
| C. | 混合气体的物质的量不再变化 | |
| D. | C的生成速率与B的生成速率的比为3:2 |
1.下列物质是电解质的是( )
| A. | CuSO4 | B. | 铝 | C. | 甲醛 | D. | 氨水 |