题目内容
1.下列说法正确的是( )| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此不能与酸溶液发生反应 |
分析 A.海水中含有电解质氯化钠,钢铁中含杂质碳等,铁、碳、氯化钠溶液形成原电池反应;
B.Na2O是活泼金属氧化物,与水反应生成氢氧化钠为电解质;
C.二氧化硅为原子晶体,不存在分子;
D.酸性氧化物大多数是非金属氧化物,如二氧化硫为酸性氧化物,能够与硝酸、氢硫酸发生氧化还原反应.
解答 解:A.海水中含有电解质氯化钠,钢铁中的铁和杂质碳在氯化钠溶液中形成原电池,铁做负极失电子被氧化,原电池能加快化学反应速率,故A错误;
B.Na2O与水反应生成电解质NaOH,氢氧化钠电离出离子溶液导电,所以Na2O的水溶液能导电,这不能说明Na2O是电解质,只有熔融状态下导电,才能说明氧化钠为电解质,故B正确;
C.二氧化硅为原子晶体,是硅原子和氧原子构成,不存在分子,没有分子式,故C错误;
D.二氧化硫为酸性氧化物,能够与硝酸、氢硫酸发生氧化还原反应,二氧化硅为酸性氧化物,和氢氟酸反应,故D错误;
故选B.
点评 本题考查了原电池原理、元素化合物知识,明确电解质、酸性氧化物的概念,注意只有分子晶体才存在分子式,题目难度不大.

练习册系列答案
相关题目
9.质量相等的下列烃,在相同条件下完全燃烧,耗氧量最多的是( )
| A. | CH4 | B. | C2H6 | C. | C2H4 | D. | C2H2 |
16.下列各组物质充分反应后,滴入KSCN溶液一定显红色的是( )
| A. | FeO放入稀HCl中 | |
| B. | CuCl2的混合溶液中加入过量的铁粉 | |
| C. | Fe在氯气中燃烧后的产物 | |
| D. | 过量Fe粉放入FeCl3溶液中 |
13.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
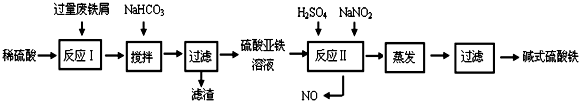
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内,使溶液中的Al3+离子沉淀.
(2)反应Ⅱ中加入NaNO2,反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标准状况),则相当于节约NaNO2的物质的量为1mol.
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合
离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.K3Fe(CN)6溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内,使溶液中的Al3+离子沉淀.
(2)反应Ⅱ中加入NaNO2,反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标准状况),则相当于节约NaNO2的物质的量为1mol.
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合
离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.K3Fe(CN)6溶液.
10.下列各表述与示意图一致的是( )
| A. | 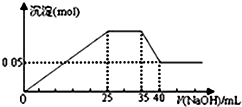 如图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol•L-1 | |
| B. |  如图中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)是,△H>0,若使用正催化剂,E值会减小 | |
| C. | 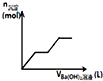 如图可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 | |
| D. | 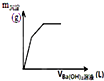 如图表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
11.科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图.下列说法错误的是( )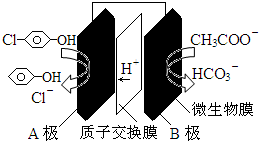

| A. | A极电极反应式为: +2e-+H+═ +2e-+H+═ +Cl- +Cl- | |
| B. | B极电极反应式为:CH3COO--8e-+4H2O═2HCO3-+9H+ | |
| C. | 溶液中的阴离子由A极向B极移动 | |
| D. | 该微生物电池在高温条件下无法正常工作 |