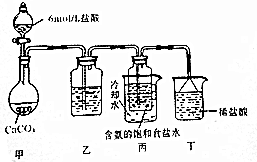
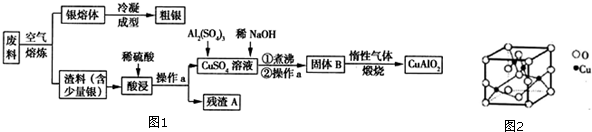
题目内容
14.用价层电子对互斥理论预测SO2和NO3-的立体结构,两个结论都正确的是( )| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
分析 价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.价层电子对就是指分子中的中心原子上的电子对,包括σ 键电子对和中心原子上的孤电子对;σ 键电子对数和中心原子上的孤电子对数之和就是价层电子对数,由于价层电子对的相互排斥,就可得到含有孤电子对的VSEPR模型,略去孤电子对就是该分子的空间构型.
解答 解:SO2的分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3且含有一个孤电子对,所以其空间构型为V形,
NO3-中价层电子对个数=3+$\frac{1}{2}×$(5+1-3×2)=3且不含孤电子对,所以为平面三角形,
故选D.
点评 本题考查了分子空间构型的判断,题目难度不大,注意把握离子和分子价层电子对数的判断方法.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
2.碳单质有多种同素异形体,下列有关叙述错误的是( )
| A. | 金刚石硬度很高,用于制作精美首饰 | |
| B. | C60分子可镶入金属钾,用做高温超导体 | |
| C. | 石墨熔沸点高,用做飞船表面隔热材料 | |
| D. | 碳纳米管导电性好,用于制作大规模集成电路 |
19.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 氯化钠溶液滴入硝酸银溶液中 Ag++Cl-═AgCl↓ | |
| D. | 次氯酸钙溶液中通入少量CO2 Ca(ClO)2+CO2+H2O═CaCO3↓+2H++2ClO- |
3.向氯化铁溶液中加入ag铜粉,完全溶解后再加入b g铁粉,充分反应后过滤得到滤液和固体c g.下列说法正确的是( )
| A. | 若a>c,则滤液中可能含三种金属离子,且b可能小于c | |
| B. | 若a>c,则c g固体中只含一种金属,且b可能大于c | |
| C. | 若a<c,则c g固体含两种金属,且b可能与c相等 | |
| D. | 若a=c,则滤液中可能含两种金属离子,且b可能小于c |
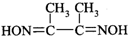 是检验Ni2+的灵敏试剂.
是检验Ni2+的灵敏试剂.