题目内容
4.下列各图所表示的“一个反应过程”符合放热反应的是( )| A. |  | B. |  | C. |  | D. |  |
分析 依据能量守恒分析,放热反应是指反应过程中反应物能量大于生成物能量,吸热反应是反应过程中反应物能量低于生成物能量,结合图象中物质能量大小和化学反应实质分析判断.
解答 解:A.图象中反应物能量低于生成物能量,反应为吸热反应,故A不符合;
B.图象中反应物能量高于生成物,反应为放热反应,故B符合;
C.化学反应实质是旧化学键断裂吸收能量,形成化学键放出能量,反应过程中一定伴随能量的变化,反应物和生成物能量不同,故C不符合;
D.化学反应实质是旧化学键断裂吸收能量,形成化学键放出能量,反应过程中反应物吸收能量能量升高,图象变化不符合,故D不符合;
故选B.
点评 本题考查了化学反应能量变化的实质理解应用,图象变化中化学反应实质和能量守恒是解题关键,题目难度不大.

练习册系列答案
相关题目
19.改变反应物用量,下列反应能用同一个反应方程式表示的是( )
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH溶液反应;
④Fe与稀硝酸反应; ⑤S在O2中燃烧; ⑥NH3与O2的反应.
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH溶液反应;
④Fe与稀硝酸反应; ⑤S在O2中燃烧; ⑥NH3与O2的反应.
| A. | ②⑤⑥ | B. | ①②③⑤ | C. | ①③④⑥ | D. | ①③④⑤⑥ |
9.等质量的两份铝分别与足量稀H2SO4和NaOH溶液反应,若消耗的两溶液的体积相等,则两溶液的物质的量浓度之比为( )
| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 1:2 |
13.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到金属的单质 | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能生成H+的化合物是酸 |
14.亚硝酸钠又称为“工业盐”,在新闻报道中常出现因误食工业盐而导致中毒的事件,下列关于亚硝酸钠的叙述不正确的是( )
| A. | 亚硝酸钠外观与食盐相似 | |
| B. | 亚硝酸钠和食盐一样也具有咸味 | |
| C. | 食盐可用作食品的添加剂而亚硝酸钠绝对不可用作食品添加剂 | |
| D. | 亚硝酸钠溶液和食盐溶液中滴加硝酸银溶液均可产生白色沉淀 |
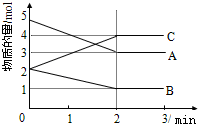 已知A、B、C均为气体,在体积为10L的恒容密闭容器中进行发生可逆反应,在0~3分钟内各物质的量的变化情况如图所示.请回答下列问题:
已知A、B、C均为气体,在体积为10L的恒容密闭容器中进行发生可逆反应,在0~3分钟内各物质的量的变化情况如图所示.请回答下列问题:
 .
. .
.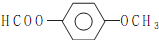 .
.