题目内容
2.某合金与铁的物理性质的比较如表所示( )| 项目 | 熔点/°C | 密度/ (g•cm-3) | 硬度(金刚 石为10) | 导电性 (银为100) |
| 某合金 | 2 500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1 535 | 7.86 | 4.5 | 17 |
| A. | 导线 | B. | 门窗框 | C. | 炉具 | D. | 飞机外壳 |
分析 从表中可看出某合金的熔点高,密度小,硬度大,导电性差.
解答 解:A.合金的导电性差,不能做电源线,故A正确;
B.合金的硬度大,可做门窗框,故B错误;
C.合金的熔点高,可做炉具,故C错误;
D.合金的硬度大,密度小,熔点高,可做飞机外壳,故D错误.
故选A.
点评 本题主要考查物质的性质、组成以及用途,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
7.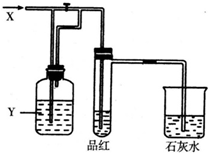 如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
 如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )| ① | ② | ③ | ④ | |
| X | SO2 | H2S | CO2 | Cl2 |
| Y | 饱和的NaHCO3溶液 | 浓硫酸 | Na2SO3溶液 | Na2CO3溶液 |
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
12.某离子化合物中,阳离子和阴离子的电子层结构与氖原子电子层结构相同,则此离子化合物化学式为( )
| A. | MgCl2 | B. | NaF | C. | MgO | D. | K2S |
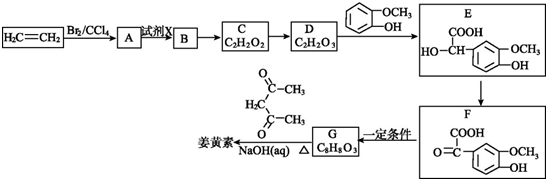
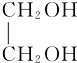 +O2$→_{△}^{Cu}$OHC-CHO+2H2O.
+O2$→_{△}^{Cu}$OHC-CHO+2H2O.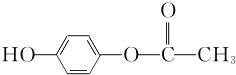 .
. .
. 理论上任何自发的氧化还原反应都可以设计成原电池.现使用锌电极、铜电极、橙子(酸性介质)设计如图所示的水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.现使用锌电极、铜电极、橙子(酸性介质)设计如图所示的水果电池.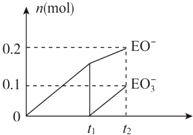 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下: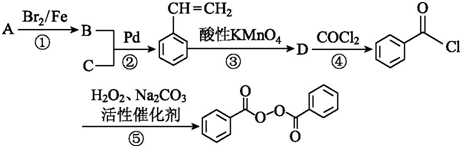
 ;
;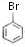 +CH2=CH2$\stackrel{Pd}{→}$
+CH2=CH2$\stackrel{Pd}{→}$ +HBr;
+HBr;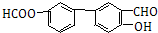 (苯环上基团位置可换);
(苯环上基团位置可换); )
)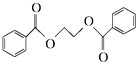 的流程图,无机物任选,注明反应条件.
的流程图,无机物任选,注明反应条件.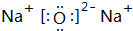 .
.