题目内容
13.如表叙述不正确的是( )| A | B | C | D |
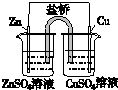 | 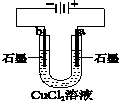 |  |  |
| 盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为:Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.原电池工作时,阴离子向负极移动;
B.a为阳极,可生成氯气;
C.粗铜为阳极,发生氧化反应;
D.发生吸氧腐蚀,正极发生还原反应.
解答 解:A.原电池工作时,阴离子向负极移动,锌为负极,盐桥中的Cl-移向ZnSO4溶液,故A正确;
B.a为阳极,发生氧化反应生成氯气.氯气和氧化KI生成碘,可使淀粉碘化钾试纸变蓝,故B正确;
C.粗铜为阳极,发生氧化反应,Cu2++2e-=Cu为阴极反应,故C错误;
D.发生吸氧腐蚀,正极发生还原反应,电极方程式为O2+4e-+2H2O=4OH-,故D正确.
故选C.
点评 本题考查较为综合,涉及原电池与电解池等知识,综合考查学生的分析能力、实验能力,注意把握原电池和电解池的工作原理以及电极的变化,难度不大.

练习册系列答案
相关题目
3.如表各组物质中,可以实现X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z(每步只发生一个反应)所示转化的选项是( )
| 选项 | X | Y | Z | M |
| A | Fe | FeCl2 | FeCl3 | Cl2 |
| B | C | CO | CO2 | O2 |
| C | CO2 | Na2CO3 | NaHCO3 | NaOH |
| D | AlO2- | Al(OH)3 | Al3+ | CO2 |
| A. | A | B. | B | C. | C | D. | D |
1.能正确表示下列反应的离子方程式是( )
| A. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O |
8.100mL 1mol•L-1的Ca(HCO3)2溶液中,放入2.3g金属钠充分反应后,有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
| 生成CaCO3 | 溶液中HCO3- | H2 | 转移的电子 | |
| A | 0.1NA | 0.1NA | ||
| B | 1.12L | 0.1NA | ||
| C | 10g | 0.05NA | ||
| D | 10g | 0.1NA |
| A. | A | B. | B | C. | C | D. | D |
5.下列有关实验原理、现象、结论均正确的是( )
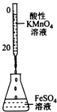
| A. |  图中滴加乙醇,试管中橙色溶液变为绿色,说明K2Cr2O4被还原成K2CrO4 | |
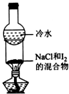
| B. |  图中,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好 | |
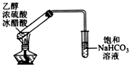
| C. |  图中,由试管中收集到的无色气体,证明铜与稀硝酸的反应产物是NO | |
| D. |  图中,试管中先出现白色沉淀、加Na2S后产生黑色沉淀,但不能验证AgCl的溶解度大于Ag2S |
2.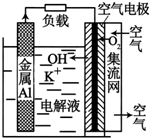 铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )
铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )
 铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )
铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )| A. | 铝-空气电池要及时回收处理,以免造成重金属污染 | |
| B. | 每消耗1molAl,电解质溶液中会有3 mol电子通过 | |
| C. | 负极上的电极反应式为:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 电池总反应式为:Al+KOH+O2═KAlO2+H2O |
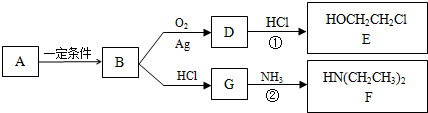
 $\stackrel{还原}{→}$
$\stackrel{还原}{→}$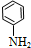 )
)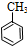 (甲苯)$→_{浓H_{2}SO_{4}}^{浓HNO_{3}}$甲$\stackrel{氧化}{→}$乙$→_{③}^{E}$
(甲苯)$→_{浓H_{2}SO_{4}}^{浓HNO_{3}}$甲$\stackrel{氧化}{→}$乙$→_{③}^{E}$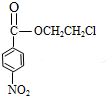 $\stackrel{还原}{→}$丙$→_{④}^{F}$
$\stackrel{还原}{→}$丙$→_{④}^{F}$ (普鲁卡因)
(普鲁卡因)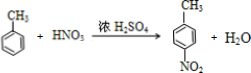 .反应③的化学方程式是(乙中有两种含氧官能团):
.反应③的化学方程式是(乙中有两种含氧官能团):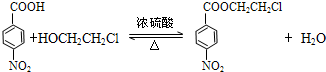 .
.