题目内容
1.能正确表示下列反应的离子方程式是( )| A. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O |
分析 A.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
B.溶液中NH4Al(SO4)2 与Ba(OH)2 以物质的量之比1:2混合,反应生成氢氧化铝、硫酸钡和一水合氨;
C.高锰酸钾具有强的氧化性,能够氧化氯离子;
D.三价铁具有氧化性能氧化碘离子.
解答 解:A.次氯酸具有氧化性,亚硫酸氢根离子具有还原性,次氯酸能将亚硫酸根离子氧化,即ClO-+SO2+H2O═SO42-+Cl-+2H+,故A错误;
B.溶液中NH4Al(SO4)2 与Ba(OH)2 以物质的量之比1:2混合,离子方程式:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+2BaSO4↓++NH3.H2O,故B错误;
C.高锰酸钾具有强的氧化性,能够氧化氯离子,所以不能用盐酸酸化,故C错误;
D.氧化铁可溶于氢碘酸,三价铁具有氧化性能氧化碘离子,反应的离子方程式为:Fe2O3+2I-+6H+=2Fe2++3H2O+I2,故D正确;
故选:D.
点评 本题考查了离子方程式的书写原则和注意问题,侧重考查氧化还原反应的离子方程式书写,明确反应实质是解题关键,题目难度中等.

练习册系列答案
相关题目
12.X、Y、Z、W、M均为短周期元素,X、Y处于同一周期,Z、W处于同一周期,X、Y 原子最外层电子数之和等于Z、W 原子最外层电子数之和,Y 是形成化合物种类最多的元素,X、W 的简单离子X2-、W3+具有相同的电子层结构,M为短周期中除稀有气体元素外原子半径最大的元素.下列说法正确的是( )
| A. | X最高价氧化物对应的水化物为强酸 | |
| B. | 原子半径大小顺序为M>W>X>Y>Z | |
| C. | 水溶液中Z 的简单单核离子能促进水的电离 | |
| D. | Z、M的最高价氧化物对应的水化物均能溶解W与X形成的化合物 |
16.一定条件下,A、B、C、D 之间的转化关系如图所示.下列说法正确的是( )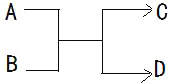

| A. | 若 A 为铁,D 为氢气,则 B 一定为酸 | |
| B. | 若 A、D 为化合物,B 为水,则 C 一定是气体单质 | |
| C. | 若 A、B、C、D 均为化合物,该反应一定属于复分解反应 | |
| D. | 若 A、B、C、D 均为 10 电子微粒,且 C 是可使湿润的红色石蕊试纸变蓝的气体,则 D 常温下一定呈液态 |
13.如表叙述不正确的是( )
| A | B | C | D |
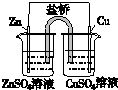 | 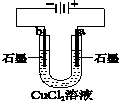 |  |  |
| 盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为:Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
| A. | A | B. | B | C. | C | D. | D |
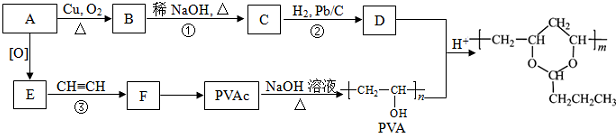
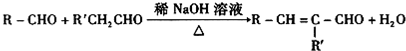
 (R、R′可表示烃基或氢原子)
(R、R′可表示烃基或氢原子)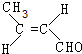 ,该分子中最多有9个原子共平面.
,该分子中最多有9个原子共平面. $→_{△}^{NaOH}$
$→_{△}^{NaOH}$ +H2O.
+H2O.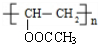 .
.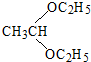 .合成路线流程图示例如下:
.合成路线流程图示例如下: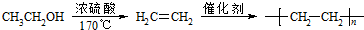

 .B的一种同类别异构体存在顺反异构,该物质发生加聚反应生成的高分子化合物的结构简式为
.B的一种同类别异构体存在顺反异构,该物质发生加聚反应生成的高分子化合物的结构简式为 .
. .
. (任写一种物质的结构简式).
(任写一种物质的结构简式). }及阻燃剂四溴双酚A.合成线路如图:
}及阻燃剂四溴双酚A.合成线路如图:

 $\stackrel{溴化钠、氯化钠、盐酸}{→}$
$\stackrel{溴化钠、氯化钠、盐酸}{→}$
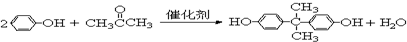 .
. =CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$
=CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$ =CHCOOR+2H2O,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
=CHCOOR+2H2O,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: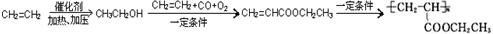 .
. ; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度.
; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度. .乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.