题目内容
5.下列有关实验原理、现象、结论均正确的是( )| A. |  图中滴加乙醇,试管中橙色溶液变为绿色,说明K2Cr2O4被还原成K2CrO4 | |
| B. |  图中,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. |  图中,由试管中收集到的无色气体,证明铜与稀硝酸的反应产物是NO | |
| D. |  图中,试管中先出现白色沉淀、加Na2S后产生黑色沉淀,但不能验证AgCl的溶解度大于Ag2S |
分析 A.K2Cr2O4与K2CrO4的Cr元素的化合价都为+6价;
B.浓度不一样,不能用于比较催化剂的影响;
C.如生成二氧化氮,可与水反应生成NO;
D.硝酸银过量,AgCl和Ag2S都生成.
解答 解:A.图中滴加乙醇,试管中橙色溶液变为绿色,说明K2Cr2O4被还原成Cr3+,故A错误;
B.双氧水的浓度应相同,浓度影响反应速率,无法比较,故B错误;
C.如生成二氧化氮,可与水反应生成NO,要检验生成的气体中只含NO,要排除氧气的干扰,避免对实验造成干扰,故C错误;
D.硝酸银过量,发生沉淀的生成,不存在沉淀的转化,不能比较AgCl、Ag2S溶解度大小,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、化学反应速率、沉淀的生成等,把握反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大,选项D为易错点.

练习册系列答案
相关题目
16.一定条件下,A、B、C、D 之间的转化关系如图所示.下列说法正确的是( )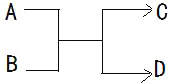

| A. | 若 A 为铁,D 为氢气,则 B 一定为酸 | |
| B. | 若 A、D 为化合物,B 为水,则 C 一定是气体单质 | |
| C. | 若 A、B、C、D 均为化合物,该反应一定属于复分解反应 | |
| D. | 若 A、B、C、D 均为 10 电子微粒,且 C 是可使湿润的红色石蕊试纸变蓝的气体,则 D 常温下一定呈液态 |
13.如表叙述不正确的是( )
| A | B | C | D |
 |  |  |  |
| 盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为:Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
| A. | A | B. | B | C. | C | D. | D |
20.将标准状况下的22.4LSO2通入3mol的NaOH溶液中,下列用来解释事实的方程式中不合理的是(已知高温下饱和Na2SO3溶液的pH约为8.3)( )
| A. | 向上述NaOH溶液中通入SO2:2OH-+SO2═SO32-+H2O | |
| B. | 上述反应后所得溶液的PH约为12:SO32-+H2O?HSO3-+OH- | |
| C. | 向上述反应后所得溶液中通入氯气,PH下降:SO32-+Cl2+2OH-═SO42-+2Cl-+H2O | |
| D. | 向上述反应后所得溶液中滴加少量H2O2和BaCl2溶液的混合液,产生白色沉淀:SO32-+Ba2++H2O2═BaSO4↓+H2O |
17. X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )
X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )
 X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )
X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )| A. | X元素位于ⅥA族 | B. | A难溶于B中 | ||
| C. | A和C不可能发生氧化还原反应 | D. | B的沸点高于C的沸点 |
14.下列实验设计正确的是( )
| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 将铁屑放入稀HNO3中证明Fe比H2活泼 | |
| C. | 将澄清石灰水滴入某溶液证明其中存在CO32- | |
| D. | 将乙烯通入KMnO4酸性溶液证明乙烯具有还原性 |

 ; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度.
; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度. .乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
 近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题:
近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题: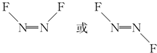 ,1molN2F2分子中所含σ键的数目是3NA.
,1molN2F2分子中所含σ键的数目是3NA.