题目内容
硫酸亚铁铵(NH4)2Fe(SO4)2?6H2O是一种浅绿色晶体,在水中的溶解度较小,不溶于乙醇.某实验小组利用镀锌铁片来制备硫酸亚铁铵的过程如下: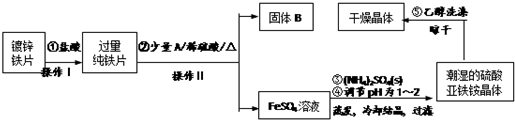
(1)加入盐酸是为了除去锌镀层,判断锌镀层已被除去的现象是 .
(2)A物质可以是 (选填序号).
a.CuCl2 b.CuSO4 c.Cu(NO3)2
加入少量A物质发生的反应化学方程式为 .
(3)操作Ⅱ的名称为 .
(4)采用晾干而不用加热烘干晶体的原因是 .
(5)工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+.写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式 .

(1)加入盐酸是为了除去锌镀层,判断锌镀层已被除去的现象是
(2)A物质可以是
a.CuCl2 b.CuSO4 c.Cu(NO3)2
加入少量A物质发生的反应化学方程式为
(3)操作Ⅱ的名称为
(4)采用晾干而不用加热烘干晶体的原因是
(5)工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+.写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式
考点:硫酸亚铁的制备
专题:实验题
分析:(1)在酸作电解质溶液的原电池中,作负极的金属加速被腐蚀,比金属与酸直接反应快;
(2)加入的物质或与稀硫酸反应后的物质能与铁反应且不引进新的杂质离子;
(3)分离固体和溶液的方法是过滤;
(4)硫酸亚铁铵晶体受热易分解且易被氧化;
(5)K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+,亚铁离子被氧化生成铁离子.
(2)加入的物质或与稀硫酸反应后的物质能与铁反应且不引进新的杂质离子;
(3)分离固体和溶液的方法是过滤;
(4)硫酸亚铁铵晶体受热易分解且易被氧化;
(5)K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+,亚铁离子被氧化生成铁离子.
解答:
解:(1)锌、铁和盐酸构成原电池,锌易失电子而作负极,构成原电池负极金属加速被腐蚀,当锌完全反应后,铁和稀盐酸不能构成原电池,则反应速率降低,所以可以根据生成气体的反应速率判断锌镀层是否已被除去,
故答案为:反应速率突然减小(或铁片表面生成的气泡突然减少);
(2)加入的物质或与稀硫酸反应后的物质能与铁反应且不引进新的杂质离子,ac能分别引进新的杂质离子氯离子、硝酸根离子,b不能引进新的杂质离子;
加入少量A,A中含有铜离子,铜离子和铁反应生成铜Fe+CuSO4=FeSO4+Cu,铜、铁和酸能构成原电池,从而加快铁与稀硫酸的反应速率,
故答案为:b;Fe+CuSO4=FeSO4+Cu;
(3)分离固体Cu和FeSO4溶液的方法是过滤,
故答案为:过滤;
(4)如果采用加热的方法制取硫酸亚铁铵,加热过程中,硫酸亚铁铵易失水,且亚铁离子易被氧气氧化,从而得不到硫酸亚铁铵晶体,
故答案为:避免加热过程中晶体受热分解失去结晶水或被空气氧化;
(5)K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+,亚铁离子被氧化生成铁离子,离子反应方程式为:6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O.
故答案为:反应速率突然减小(或铁片表面生成的气泡突然减少);
(2)加入的物质或与稀硫酸反应后的物质能与铁反应且不引进新的杂质离子,ac能分别引进新的杂质离子氯离子、硝酸根离子,b不能引进新的杂质离子;
加入少量A,A中含有铜离子,铜离子和铁反应生成铜Fe+CuSO4=FeSO4+Cu,铜、铁和酸能构成原电池,从而加快铁与稀硫酸的反应速率,
故答案为:b;Fe+CuSO4=FeSO4+Cu;
(3)分离固体Cu和FeSO4溶液的方法是过滤,
故答案为:过滤;
(4)如果采用加热的方法制取硫酸亚铁铵,加热过程中,硫酸亚铁铵易失水,且亚铁离子易被氧气氧化,从而得不到硫酸亚铁铵晶体,
故答案为:避免加热过程中晶体受热分解失去结晶水或被空气氧化;
(5)K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+,亚铁离子被氧化生成铁离子,离子反应方程式为:6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O.
点评:本题考查了制备实验方案的设计,侧重考查学生分析问题、解决问题的能力,知道原电池原理、除杂原理、离子方程式的书写、氧化还原反应是解答关键,题目难度中等.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
下列化学用语中,书写正确的是( )
A、CO2的比例模型: |
B、氮气的电子式: |
C、乙醇的球棒模型 |
D、聚乙烯的结构简式: |
COCl2(g)?CO(g)+Cl2(g)△H>0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是( )


| A、①表示随温度升高,平衡常数的变化 |
| B、②表示t1时刻加入催化剂,反应速率随时间的变化 |
| C、③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化 |
| D、④表示CO的体积分数随充入Cl2量的变化 |
下列关于电解质溶液中离子浓度关系的说法正确的是( )
| A、0.1mol/L的NaHCO3溶液中离子浓度的关系:c(Na+)═c(HCO3-)+c(H2CO3)+2c(CO32-) |
| B、0.1mol/L的NH4Cl溶液和0.1mol/L的NH3?H2O等体积混合后离子浓度的关系:c(NH4+)>c( Cl-)>c(OH-)>c(H+) |
| C、常温下,物质的量浓度相等的醋酸溶液与氢氧化钠溶液等体积混合,所得溶液PH=7 |
| D、KHS溶液中存在等式关系:c(S2-)+c(OH-)=c(H+)+c(H2S) |
已知A、B为单质,C为化合物.能实现上述转化关系的是( )
A+B
C
A+B
①符合上述转化关系的C溶于水不可能得到强碱溶液
②若C的溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若A为光亮红色金属,则B可能为S
④若C的溶液中滴加铁氰化钾溶液有蓝色沉淀生成,则B可能为Cl2.
A+B
| 点燃 |
| 溶于水 |
| 惰性电极电解 |
①符合上述转化关系的C溶于水不可能得到强碱溶液
②若C的溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若A为光亮红色金属,则B可能为S
④若C的溶液中滴加铁氰化钾溶液有蓝色沉淀生成,则B可能为Cl2.
| A、①②④ | B、②④ |
| C、①②③ | D、①② |
在一定条件下,将2mol A和1mol B混合于固定容积为2L的密闭容器中,发生如下反应:
,5s时测得气体压强是反应前的
,此段时间内C的平均生成率为( )
| 3A(g)+B(g) |
| xC(g)+2D(g) |
| 5 |
| 6 |
| A、0.25mol/L/s |
| B、0.1 |
| C、0.05mol/(L?s) |
| D、条件不足,无法计算 |