题目内容
COCl2(g)?CO(g)+Cl2(g)△H>0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是( )


| A、①表示随温度升高,平衡常数的变化 |
| B、②表示t1时刻加入催化剂,反应速率随时间的变化 |
| C、③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化 |
| D、④表示CO的体积分数随充入Cl2量的变化 |
考点:化学平衡建立的过程
专题:图示题,化学平衡专题
分析:A、反应是吸热反应,升温平衡正向进行,平衡常数增大;
B、催化剂改变反应速率不改变化学平衡;
C、恒压容器中加入与平衡无关的气体,体积增大,压强减小,平衡正向进行;
D、加入Cl2平衡逆向进行.
B、催化剂改变反应速率不改变化学平衡;
C、恒压容器中加入与平衡无关的气体,体积增大,压强减小,平衡正向进行;
D、加入Cl2平衡逆向进行.
解答:
解:A、反应是吸热反应,升温平衡正向进行,平衡常数增大,图象不符合平衡常数变化,故A错误;
B、催化剂改变反应速率不改变化学平衡,速率同等程度增大,速率变化曲线不符合,故B错误;
C、恒压容器中加入与平衡无关的气体,体积增大,压强减小,平衡正向进行,反应物转化率增大,故C错误;
D、加入Cl2平衡逆向进行,CO的体积分数减小,故D正确;
故选D.
B、催化剂改变反应速率不改变化学平衡,速率同等程度增大,速率变化曲线不符合,故B错误;
C、恒压容器中加入与平衡无关的气体,体积增大,压强减小,平衡正向进行,反应物转化率增大,故C错误;
D、加入Cl2平衡逆向进行,CO的体积分数减小,故D正确;
故选D.
点评:本题考查了化学平衡、平衡常数、反应速率影响因素分析判断,图象变化和反应特征是解题关键,题目难度中等.

练习册系列答案
相关题目
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
| A、H2XO3 |
| B、HXO3 |
| C、H3XO4 |
| D、H2XO4 |
设NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A、常温常压下,48gO3含有的氧原子数为3NA |
| B、1.8g的NH4+离子中含有的电子数为NA |
| C、物质的量浓度为0.5mol/L Mg Cl2溶液,含有Cl-离子数为NA |
| D、标准状况下,11.2 L氧气所含的原子数为NA |
下列做法中不符合“绿色化学”思想的是( )
| A、以水性涂料代替油性涂料 |
| B、以无磷洗涤剂代替含磷洗涤剂 |
| C、实验后的有毒有害物质应分类收集、统一处理 |
| D、在通风橱中制氯气时不用NaOH溶液吸收尾气 |
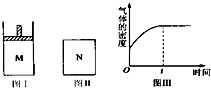 在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a mol A和a mol B,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)?xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4,下列判断不正确的是( )
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a mol A和a mol B,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)?xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4,下列判断不正确的是( )| A、x=4 |
| B、若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态 |
| C、若A为气体,B为非气体,则平衡时M、N中C的物质的量相等 |
| D、若A、B均为气体,平衡时M中A的转化率大于N中A的转化率 |
下列关于化工生产原理的叙述中,均符合目前工业生产实际的是( )
| A、氯碱工业中,电解槽的阳极区产生NaOH |
| B、氯气和氢气混合在光照条件下反应生成氯化氢,用水吸收得到盐酸 |
| C、合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体上氨的产率很高 |
| D、二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸 |
只用一种试剂,区别甲苯,四氯化碳,己烯,乙醇,碘化钾溶液,亚硫酸6种无色溶液,应选用( )
| A、酸性KMnO4溶液 |
| B、溴水 |
| C、碘水 |
| D、硝酸银溶液 |