题目内容
A、B、C、D均为中学化学所学的常见物质,它们之间的转化关系如下列各图所示(部分反应条件或产物已略去).请按要求回答下列问题:

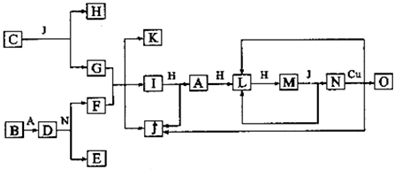
(1)若A、B、C、D均含有同一种短周期元素X,它们的转化关系如图l所示:
①常温下,若A为化合物,C为红棕色气体,D为强电解质,则X所在周期表中的位置是 ;用方程式表示A溶于水,使酚酞变红的原因: .
②常温下,若A为固体单质,D为强电解质,则D可能的化学式为 、 .符合上述条件且含有离子键的C的电子式: .
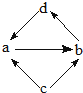
(2)若A、B、C均含有同一种短周期元素Y,它们的转化关系如图2所示:
若Y的周期数等于主族序数;盐A溶液显酸性:盐B溶液显碱性,且焰色反应为黄色;C为两性氢氧化物.
请用离子方程表示B溶液显碱性的原因: .
在实验室里,欲使A溶液中的阳离子全部沉淀出来转化为C,所发生化学反应的离子方程式为 .

(1)若A、B、C、D均含有同一种短周期元素X,它们的转化关系如图l所示:
①常温下,若A为化合物,C为红棕色气体,D为强电解质,则X所在周期表中的位置是
②常温下,若A为固体单质,D为强电解质,则D可能的化学式为
(2)若A、B、C均含有同一种短周期元素Y,它们的转化关系如图2所示:
若Y的周期数等于主族序数;盐A溶液显酸性:盐B溶液显碱性,且焰色反应为黄色;C为两性氢氧化物.
请用离子方程表示B溶液显碱性的原因:
在实验室里,欲使A溶液中的阳离子全部沉淀出来转化为C,所发生化学反应的离子方程式为
考点:无机物的推断
专题:推断题
分析:(1)若A、B、C、D均含有同一种短周期元素X,
①C为红棕色气体,应为NO2,A为化合物,D为强电解质,结合转化关系,可知A为NH3、B为NO、D为HNO3,氨水中一水合氨电离溶液呈碱性,而使酚酞变红;
②常温下,若A为固体单质,D为强电解质,结合转化关系可知,A为Na、B为氧化钠、C为过氧化钠、D为NaOH(或A为S、B为二氧化硫、C为三氧化硫、D为硫酸)符合转化关系,含有离子键的C为过氧化钠,由钠离子与过氧根离子构成;
(2)若A、B、C均含有同一种短周期元素Y,C为两性氢氧化物,则C为Al(OH)3,Y的周期数等于主族序数,即Y为Al,盐B溶液显碱性,且焰色反应为黄色,则B为NaAlO2,盐A溶液显酸性,则A为铝盐.
①C为红棕色气体,应为NO2,A为化合物,D为强电解质,结合转化关系,可知A为NH3、B为NO、D为HNO3,氨水中一水合氨电离溶液呈碱性,而使酚酞变红;
②常温下,若A为固体单质,D为强电解质,结合转化关系可知,A为Na、B为氧化钠、C为过氧化钠、D为NaOH(或A为S、B为二氧化硫、C为三氧化硫、D为硫酸)符合转化关系,含有离子键的C为过氧化钠,由钠离子与过氧根离子构成;
(2)若A、B、C均含有同一种短周期元素Y,C为两性氢氧化物,则C为Al(OH)3,Y的周期数等于主族序数,即Y为Al,盐B溶液显碱性,且焰色反应为黄色,则B为NaAlO2,盐A溶液显酸性,则A为铝盐.
解答:
解:(1)若A、B、C、D均含有同一种短周期元素X,
①C为红棕色气体,应为NO2,A为化合物,D为强电解质,结合转化关系,可知A为NH3、B为NO、D为HNO3,
X为氮元素,处于第二周期ⅤA族,氨水中一水合氨电离:NH3+H2O?NH3.H2O?NH4++OH-,溶液呈碱性,而使酚酞变红,
故答案为:第二周期ⅤA族;NH3+H2O?NH3.H2O?NH4++OH-;
②常温下,若A为固体单质,D为强电解质,结合转化关系可知,A为Na、B为氧化钠、C为过氧化钠、D为NaOH,或A为S、B为二氧化硫、C为三氧化硫、D为硫酸,符合转化关系,含有离子键的C为过氧化钠,由钠离子与过氧根离子构成,其电子式为: ,
,
故答案为:NaOH、H2SO4; ;
;
(2)若A、B、C均含有同一种短周期元素Y,C为两性氢氧化物,则C为Al(OH)3,Y的周期数等于主族序数,即Y为Al,盐B溶液显碱性,且焰色反应为黄色,则B为NaAlO2,盐A溶液显酸性,则A为铝盐,则:
NaAlO2溶液中AlO2-水解:AlO2-+2H2O?Al(OH)3+OH-,破坏水的电离平衡,溶液呈碱性,
在实验室里,欲使铝盐溶液中的阳离子全部沉淀出来转化为氢氧化铝,可以用铝盐溶液与氨水反应得到,所发生化学反应的离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:AlO2-+2H2O?Al(OH)3+OH-;Al3++3NH3.H2O=Al(OH)3↓+3NH4+.
①C为红棕色气体,应为NO2,A为化合物,D为强电解质,结合转化关系,可知A为NH3、B为NO、D为HNO3,
X为氮元素,处于第二周期ⅤA族,氨水中一水合氨电离:NH3+H2O?NH3.H2O?NH4++OH-,溶液呈碱性,而使酚酞变红,
故答案为:第二周期ⅤA族;NH3+H2O?NH3.H2O?NH4++OH-;
②常温下,若A为固体单质,D为强电解质,结合转化关系可知,A为Na、B为氧化钠、C为过氧化钠、D为NaOH,或A为S、B为二氧化硫、C为三氧化硫、D为硫酸,符合转化关系,含有离子键的C为过氧化钠,由钠离子与过氧根离子构成,其电子式为:
 ,
,故答案为:NaOH、H2SO4;
 ;
;(2)若A、B、C均含有同一种短周期元素Y,C为两性氢氧化物,则C为Al(OH)3,Y的周期数等于主族序数,即Y为Al,盐B溶液显碱性,且焰色反应为黄色,则B为NaAlO2,盐A溶液显酸性,则A为铝盐,则:
NaAlO2溶液中AlO2-水解:AlO2-+2H2O?Al(OH)3+OH-,破坏水的电离平衡,溶液呈碱性,
在实验室里,欲使铝盐溶液中的阳离子全部沉淀出来转化为氢氧化铝,可以用铝盐溶液与氨水反应得到,所发生化学反应的离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:AlO2-+2H2O?Al(OH)3+OH-;Al3++3NH3.H2O=Al(OH)3↓+3NH4+.
点评:本题考查无机物推断,涉及N、Na、S、Al元素化合物的性质及转化,需要学生熟练掌握元素化合物知识,侧重对化学用语的考查,难度中等.

练习册系列答案
相关题目
工业酒精与用粮食发酵产生的酒精成份不完全相同.严禁用工业酒精勾兑食用酒,否则会使人双目失明甚至死亡.工业酒精中的主要有毒成份是( )
| A、甲醇 | B、甲醛 | C、甲酸 | D、甲苯 |
下列说法错误的是( )
A、按照系统命名法, 的名称为3,3,4-三甲基己烷 的名称为3,3,4-三甲基己烷 |
| B、乙醇、乙酸和乙酸乙酯可以用饱和Na2CO3溶液鉴别 |
| C、苯乙烯中所有原子可能共平面 |
D、1.0mol的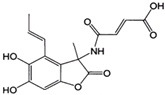 与NaOH溶液和Br2反应时,分别需要消耗NaOH 5.0mol和Br2 3.0mol 与NaOH溶液和Br2反应时,分别需要消耗NaOH 5.0mol和Br2 3.0mol |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为:4Al+3O2+6H2O═4Al(OH)3,下列说法不正确的是( )
| A、正极反应式为:O2+2H2O+4e-═40H - |
| B、电池工作时,电流由铝电极沿导线流向铂电极 |
| C、以网状的铂为正极,可增大与氧气的接触面积 |
| D、该电池通常只需更换铝板就可继续使用 |
某同学对“CO2是共价化合物和NH4Cl是离子化合物”有下列感悟,其中不正确的是( )
| A、离子化合物中可能含共价键 |
| B、共价化合物中一定不含离子键 |
| C、所有物质中都含有化学键 |
| D、离子化合物中不一定含金属元素 |