题目内容
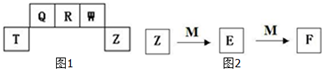 短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题:
短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题:(1)Q 的气态氢化物甲的分子式为
(2)Q、R、W的非金属性强弱顺序为
(3)Z 元素比R 元素的非金属性强.能证明这一结论的事实是
①相同条件下,Z 单质在水中的溶解性强于R 单质
②Z单质与氢气化合比R 单质与氢气化合容易
③Z的氢化物比R 的氢化物稳定
④Q的最高价含氧酸是弱酸,R的最高价含氧酸是强酸
(4)向T的硫酸盐中加入足量的Ba(OH)2溶液,写出该反应的离子方程式:
(5)QW 和RW都是汽车尾气中含有的大气污染物,它们在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,化学方程式为
(6)M是一种常见的金属单质,与元素Z的单质有如图2所示转化关系:E转化为F的反应的离子方程式是
考点:无机物的推断,位置结构性质的相互关系应用
专题:推断题,元素周期律与元素周期表专题
分析:短周期元素T、Q、R、W、Z在元素周期表中的位置可知,T、Z处于第三周期,Q、R、W处于第二周期,T所处的周期序数与主族序数相等,则Z为Al,可推知Q为C、R为N、W为O、Z为Cl,
(1)Q 的气态氢化物甲为甲烷,是正四面体结构,与氯气在光照下发生取代反应;
(2)同周期随原子序数增大,元素非金属性增强;核电荷数越大、原子半径越小,原子核对最外层电子的吸引力更大,得电子能力更强;
(3)单质溶解性,属于物理性质,不能比较元素非金属性强弱;氮气分子中为N≡N,化学性质稳定,不能根据与氢气反应难易比较非金属性强弱,可以根据氢化物稳定性、最高价含氧酸的酸性强弱比较;
(4)硫酸铝溶液中加入足量的氢氧化钡溶液生成硫酸钡沉淀与偏铝酸钡;
(5)CO 和NO都是汽车尾气中含有的大气污染物,在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,应适时氮气与二氧化碳;
(6)M是一种常见的金属单质,由转化关系可知,为变价金属,可推知M为Fe、E为FeCl3、F为FeCl2,据此解答.
(1)Q 的气态氢化物甲为甲烷,是正四面体结构,与氯气在光照下发生取代反应;
(2)同周期随原子序数增大,元素非金属性增强;核电荷数越大、原子半径越小,原子核对最外层电子的吸引力更大,得电子能力更强;
(3)单质溶解性,属于物理性质,不能比较元素非金属性强弱;氮气分子中为N≡N,化学性质稳定,不能根据与氢气反应难易比较非金属性强弱,可以根据氢化物稳定性、最高价含氧酸的酸性强弱比较;
(4)硫酸铝溶液中加入足量的氢氧化钡溶液生成硫酸钡沉淀与偏铝酸钡;
(5)CO 和NO都是汽车尾气中含有的大气污染物,在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,应适时氮气与二氧化碳;
(6)M是一种常见的金属单质,由转化关系可知,为变价金属,可推知M为Fe、E为FeCl3、F为FeCl2,据此解答.
解答:
解:短周期元素T、Q、R、W、Z在元素周期表中的位置可知,T、Z处于第三周期,Q、R、W处于第二周期,T所处的周期序数与主族序数相等,则Z为Al,可推知Q为C、R为N、W为O、Z为Cl,
(1)Q 的气态氢化物甲为甲烷,化学式为CH4,是正四面体结构,与氯气在光照下发生取代反应,反应方程式为:CH4+Cl2
CH3Cl+HCl等,
故答案为:CH4;正四面体;CH4+Cl2
CH3Cl+HCl等;
(2)同周期随原子序数增大,元素非金属性增强,则非金属性O>N>C,由于核电荷数O>N>C、原子半径O<N<C,核电荷数越大、原子半径越小,原子核对最外层电子的吸引力更大,故非金属性O>N>C,
故答案为:O>N>C;核电荷数O>N>C、原子半径O<N<C,核电荷数越大、原子半径越小,原子核对最外层电子的吸引力更大,故非金属性O>N>C;
(3)①单质溶解性,属于物理性质,不能比较元素非金属性强弱,故①错误;
②氮气分子中为N≡N,化学性质稳定,不能根据与氢气反应难易比较非金属性强弱,故②错误;
③元素氢化物越稳定,说明该元素非金属性越强,故③正确;
④元素最高价含氧酸的酸性越强,元素非金属性越强,故④正确,
故答案为:③④;
(4)硫酸铝溶液中加入足量的氢氧化钡溶液生成硫酸钡沉淀与偏铝酸钡,反应离子方程式为:2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O,
故答案为:2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O;
(5)CO 和NO都是汽车尾气中含有的大气污染物,在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,应适时氮气与二氧化碳,反应方程式为:2CO+2NO
N2+2CO2,
故答案为:2CO+2NO
N2+2CO2;
(6)M是一种常见的金属单质,由转化关系可知,M为变价金属,可推知M为Fe、E为FeCl3、F为FeCl2,则:
E转化为F的反应的离子方程式是:Fe3++2Fe=3Fe2+,把一定量的Fe 放入FeCl3溶液中,完全反应后,所得溶液中FeCl3、FeCl2的物质的量相等,令FeCl3、FeCl2的物质的量分别为3mol,由方程式可知参加反应的
FeCl3为1mol,则反应的FeCl3与未反应的FeCl3的物质的量之比=1mol:3mol=1:3,
故答案为:Fe3++2Fe=3Fe2+;1:3.
(1)Q 的气态氢化物甲为甲烷,化学式为CH4,是正四面体结构,与氯气在光照下发生取代反应,反应方程式为:CH4+Cl2
| 光照 |
故答案为:CH4;正四面体;CH4+Cl2
| 光照 |
(2)同周期随原子序数增大,元素非金属性增强,则非金属性O>N>C,由于核电荷数O>N>C、原子半径O<N<C,核电荷数越大、原子半径越小,原子核对最外层电子的吸引力更大,故非金属性O>N>C,
故答案为:O>N>C;核电荷数O>N>C、原子半径O<N<C,核电荷数越大、原子半径越小,原子核对最外层电子的吸引力更大,故非金属性O>N>C;
(3)①单质溶解性,属于物理性质,不能比较元素非金属性强弱,故①错误;
②氮气分子中为N≡N,化学性质稳定,不能根据与氢气反应难易比较非金属性强弱,故②错误;
③元素氢化物越稳定,说明该元素非金属性越强,故③正确;
④元素最高价含氧酸的酸性越强,元素非金属性越强,故④正确,
故答案为:③④;
(4)硫酸铝溶液中加入足量的氢氧化钡溶液生成硫酸钡沉淀与偏铝酸钡,反应离子方程式为:2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O,
故答案为:2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O;
(5)CO 和NO都是汽车尾气中含有的大气污染物,在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,应适时氮气与二氧化碳,反应方程式为:2CO+2NO
| ||
故答案为:2CO+2NO
| ||
(6)M是一种常见的金属单质,由转化关系可知,M为变价金属,可推知M为Fe、E为FeCl3、F为FeCl2,则:
E转化为F的反应的离子方程式是:Fe3++2Fe=3Fe2+,把一定量的Fe 放入FeCl3溶液中,完全反应后,所得溶液中FeCl3、FeCl2的物质的量相等,令FeCl3、FeCl2的物质的量分别为3mol,由方程式可知参加反应的
FeCl3为1mol,则反应的FeCl3与未反应的FeCl3的物质的量之比=1mol:3mol=1:3,
故答案为:Fe3++2Fe=3Fe2+;1:3.
点评:本题考查结构性质位置关系、无机物推断,推断元素是解题关键,综合考查学生对知识的迁移运用能力,(3)为易错点,学生容易利用单质与氢气反应难易比较N、Cl非金属性强弱,难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
有甲、乙、丙三种试液,在氢氧化钡溶液中加入甲有白色沉淀生成,在沉淀中加入乙,沉淀完全溶解并产生气泡,最后向所得溶液中加入丙又产生白色沉淀,则甲、乙、丙依次是( )
| A、K2CO3、HCl、CaCl2 |
| B、Na2CO3、HNO3、MgSO4 |
| C、Na2CO3、HCl、Ba(NO3)2 |
| D、H2SO4、Na2CO3、AgNO3 |
下列说法正确的是( )
| A、使石蕊试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-能大量共存 |
| B、含有大量AlO2-的溶液中:Na+、Ba2+、Cl-、HCO3- 能大量共存 |
| C、澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl-不能大量共存 |
| D、c(H+)=0.1mol?L-1的溶液中:Na+、Mg2+、SO42-、ClO-不能大量共存 |
下列反应中,属于取代反应的是( )
A、CH4+2O2
| ||
B、CH3CH3+Cl2
| ||
| C、Zn+H2SO4═ZnSO4+H2↑ | ||
| D、CH3COOH+NaOH═CH3COONa+H2O |
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表: 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: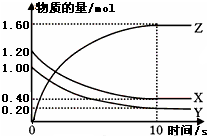 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则