题目内容
20.下列关于物质的量浓度表述正确的是( )| A. | 0.2mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL 2mol•L-1的NaCl溶液和100 mL L 0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol•L-1 | |
| D. | 10g 98%的硫酸(密度为1.84g•cm-3)与10mL 18.4mol•L-1的硫酸的浓度是相同的 |
分析 A.溶液体积不知不能计算微粒数;、
B.结合各选项中化学式判断溶液中氯离子浓度,注意离子的浓度与溶液的体积无关,与物质的构成有关;
C.用1L水吸收22.4L氯化氢(标况下)所得盐酸溶液体积不是1L;
D.据c=$\frac{1000ρw}{M}$来计算.
解答 解:A.0.2mol•L-1 Na2SO4溶液体积不知不能计算微粒数,故A错误;
B.50mL 2mol•L-1的NaCl溶液中氯离子浓度为2mol/L,100 mL L 0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度位0.5mol/L×2=1mol/L,Cl-的物质的量浓度不相等,故B错误;
C.用1L水吸收22.4L氯化氢(标况下)物质的量为1mol,所得盐酸溶液体积不是1L,所得溶液的浓度小于1mol•L-1 ,故C错误;
D.据c=$\frac{1000ρw}{M}$可知,98%硫酸(密度为1.84g•cm-3)的物质的量浓度c=$\frac{1000×1.84g/c{m}^{-3}×98%}{98g/mol}$=18.4mol•L-1,与10mL 18.4 mol•L-1硫酸的浓度是相同的,故D正确.
故选D.
点评 本题考查的是物质的量浓度和离子数目的相关计算、物质的量浓度和溶质质量分数换算,注意物质的量公式的相关应用,题目难度中等.

练习册系列答案
相关题目
10.(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图图1违背能量最低原理、泡利原理,B元素位于周期表五个区域中的S区.
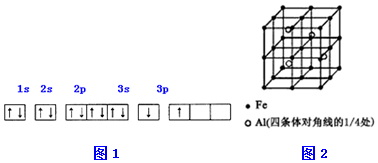
②ACl2分子中A的杂化类型为SP,ACl2的空间构型为直线.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为8.
②写出一种与CN-互为等电子体的单质的电子式 .
.
③六氰合亚铁离子Fe(CN)64-中不存在B.A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al-Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式Fe2Al.
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm.
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |

②ACl2分子中A的杂化类型为SP,ACl2的空间构型为直线.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为8.
②写出一种与CN-互为等电子体的单质的电子式
 .
.③六氰合亚铁离子Fe(CN)64-中不存在B.A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al-Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式Fe2Al.
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm.
11.能证明碳酸酸性比硅酸酸性强的事实是( )
| A. | 碳酸能溶于水,硅酸不能 | |
| B. | CO2通入硅酸钠溶液后生成白色硅酸沉淀 | |
| C. | Na2CO3和SiO2高温反应生成Na2SiO3和CO2 | |
| D. | 盐酸和Na2CO3反应生成CO2,盐酸和Na2SiO3反应生成硅酸 |
8.在反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,当有6.3g硝酸被还原时,则参加反应的铜的量为( )
| A. | 0.15mol | B. | 0.0375mol | C. | 2.4g | D. | 19.2g |
5.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO中少量的CO2 | 通过足量灼热CuO |
| B | 除去CuCO3中的少量CuO | 加入足量稀H2SO4后,过滤 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀HCl |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
12.下列物质之间的化学反应不可进行的是( )
| A. | Cl2+NaBr | B. | Br2+KI | C. | Br2+KCl | D. | Cl2+KI |
16.下列各物质中,不能够按照 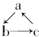 (“→”表示一步完成)关系相互转化的有( )
(“→”表示一步完成)关系相互转化的有( )
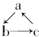 (“→”表示一步完成)关系相互转化的有( )
(“→”表示一步完成)关系相互转化的有( )| 物质 编号 | a | b | c |
| 1 | Al2O3 | NaAlO2 | Al(OH)3 |
| 2 | FeO | Fe(NO3)2 | Fe(OH)2 |
| 3 | MgCl2 | Mg(OH)2 | MgO |
| 4 | CuO | CuSO4 | Cu(OH)2 |
| 5 | Si | SiO2 | H2SiO3 |
| 6 | C | CO | CO2 |
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |

