题目内容
12.下列物质之间的化学反应不可进行的是( )| A. | Cl2+NaBr | B. | Br2+KI | C. | Br2+KCl | D. | Cl2+KI |
分析 氧化性Cl2>Br2>I2,以此判断卤素单质之间的置换反应,以此来解答.
解答 解:A.氧化性Cl2>Br2,则Cl2+NaBr能发生,故A不选;
B.氧化性Br2>I2,则Br2+KI能发生,故B不选;
C.氧化性Cl2>Br2,则Br2+KCl不能进行,故C选;
D.氧化性Cl2>I2,则Cl2+KI能发生,故D不选;
故选C.
点评 本题考查氧化还原反应及卤素单质的性质,为高频考点,把握物质的性质、氧化性的强弱为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
2.下列说法正确的是( )
| A. | 氢化物的沸点:H2O>PH3>NH3 | |
| B. | 第三周期元素(除惰性元素),随着原子序数的递增,元素的最高化合价逐渐升高 | |
| C. | 同主族元素从上到下,非金属性逐渐增强,金属性逐减弱 | |
| D. | P的非金属性强于Si,H2SiO3的酸性强于H3PO4 |
3.在浓度均为4mol•L-1的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2:3,则加入铁粉的质量是( )
| A. | 22.4 g | B. | 16.8 g | C. | 11.2 g | D. | 8.4 g |
20.下列关于物质的量浓度表述正确的是( )
| A. | 0.2mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL 2mol•L-1的NaCl溶液和100 mL L 0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol•L-1 | |
| D. | 10g 98%的硫酸(密度为1.84g•cm-3)与10mL 18.4mol•L-1的硫酸的浓度是相同的 |
7.常温下,某溶液中水电离出的H+浓度为1×10-13mol•L-1,有关该溶液的说法正确的是( )
| A. | 加入铝粉一定能产生大量H2 | |
| B. | 溶液中OH-的浓度一定为0.1mol•L-1 | |
| C. | 还可能大量存在Na+、NH4+‘Cl-、S2O32- | |
| D. | 通入少量 HCl 气体可能会使溶液中水的电离程度增大 |
3.如图所示可逆反应:mA(g)+nB(g)?xC(g),△H=Q kJ/mol,在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是( )
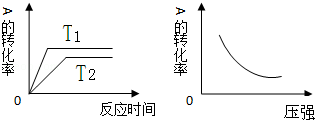

| A. | Q<0,m+n<x | B. | Q<0,m+n>x | C. | Q>0,m+n<x | D. | Q>0,m+n>x |
7.下列有关化学反应现象或化学原理的解释不正确的是( )
| 选项 | 现象或反应 | 原理解释 |
| A | 2CO=2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S>0 |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | Al2O3熔点高于Al单质 |
| C | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是被蒸馏物质的沸点 |
| D | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |