题目内容
8.在反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,当有6.3g硝酸被还原时,则参加反应的铜的量为( )| A. | 0.15mol | B. | 0.0375mol | C. | 2.4g | D. | 19.2g |
分析 3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,3molCu参加反应,还原的硝酸为2mol,以此计算.
解答 解:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,由电子守恒及原子守恒可知,3molCu被氧化,还原的硝酸为2mol,
当有6.3g硝酸被还原时,则参加反应的铜的量为$\frac{6.3g}{63g/mol}$×$\frac{3}{2}$mol=0.15mol,质量为0.15mol×64g/mol=9.6g;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析能力、计算能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列叙述正确的是( )
| A. | 常温下c(H+)为0.01 mol/L的盐酸由H2O电离出的c(H+)=1.0×10-2mol•L-1 | |
| B. | 室温下,对于0.10 mol•L-1的氨水,加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| C. | 有关反应:(tBuNO)2??2(tBuNO),压强越大,反应物的转化率越大 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
16.欲配制100mL 1.0mol/LNa2CO3溶液,正确的方法是( )
| A. | 称量10.6 g Na2CO3溶于100 mL水中 | |
| B. | 称量10.6 g Na2CO3•10H2O溶于少量水中,再用水稀释至100 mL | |
| C. | 量取20 mL 5.0 mol/L Na2CO3溶液用水稀释至100 mL | |
| D. | 配制80 mL 1.0 mol/L Na2CO3溶液,则只需要称量8.5 g Na2CO3 |
3.在浓度均为4mol•L-1的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2:3,则加入铁粉的质量是( )
| A. | 22.4 g | B. | 16.8 g | C. | 11.2 g | D. | 8.4 g |
13.下列陈述I、II均正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | Fe2O3是红棕色粉末 | Fe2O3常做红色涂料 |
| B | SiO2是两性氧化物 | SiO2可和HF反应 |
| C | Al2O3难溶于水 | Al2O3可用作耐火材料 |
| D | SO2有漂白性 | SO2可使溴水褪色 |
| A. | A | B. | B | C. | C | D. | D |
20.下列关于物质的量浓度表述正确的是( )
| A. | 0.2mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL 2mol•L-1的NaCl溶液和100 mL L 0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol•L-1 | |
| D. | 10g 98%的硫酸(密度为1.84g•cm-3)与10mL 18.4mol•L-1的硫酸的浓度是相同的 |
3.如图所示可逆反应:mA(g)+nB(g)?xC(g),△H=Q kJ/mol,在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是( )
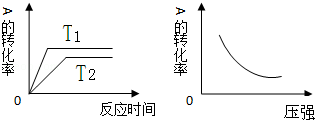

| A. | Q<0,m+n<x | B. | Q<0,m+n>x | C. | Q>0,m+n<x | D. | Q>0,m+n>x |
4.(1)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应.
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
则△H3与△H1、△H2之间的关系是:△H3=2△H2-△H1.
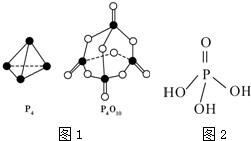
(2)白磷与氧气反应生成P4O10固体.下表所示是部分化学键的键能参数:
根据图1的分子结构和有关数据通过计算写出该反应的热化学方程式为P4(s)+5O2(g)═P4O10(s)△H=-(4c+12b-6a-5d)kJ•mol-1.
(3)三聚磷酸可视为三个磷酸分子(磷酸结构式如图2)之间脱去两个水分子产物,其结构式为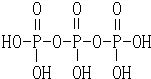 ,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
(4)已知298K时白磷不完全燃烧的热化学方程式为:P4(s,白磷)+3O2(g)═P4O6(s)△H=-1 638kJ•mol-1.
在某密闭容器中加入62g白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应.则所得到的P4O10与P4O6的物质的量之比为3:1.

反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
则△H3与△H1、△H2之间的关系是:△H3=2△H2-△H1.
(2)白磷与氧气反应生成P4O10固体.下表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | P═O | O═O |
| 键能/kJ•mol-1 | a | b | c | d |
(3)三聚磷酸可视为三个磷酸分子(磷酸结构式如图2)之间脱去两个水分子产物,其结构式为
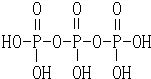 ,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.(4)已知298K时白磷不完全燃烧的热化学方程式为:P4(s,白磷)+3O2(g)═P4O6(s)△H=-1 638kJ•mol-1.
在某密闭容器中加入62g白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应.则所得到的P4O10与P4O6的物质的量之比为3:1.