题目内容
15.在20℃将10.05g KC1的饱和溶液蒸干后得到2.55g KC1,求该温度KC1的溶解度.分析 设溶液的溶解度为ag,则$\frac{ag}{100g+ag}=\frac{2.55g}{10.05g}$,据此计算.
解答 解:在20℃将10.05g KC1的饱和溶液蒸干后得到2.55g KC1,
设溶液的溶解度为ag,则$\frac{ag}{100g+ag}=\frac{2.55g}{10.05g}$,解得a=34g.
答:该温度KC1的溶解度为34g.
点评 本题考查了溶解度的有关计算,题目难度不大,侧重于考查学生的分析能力和计算能力,注意把握溶解度的概念和计算方法.

练习册系列答案
相关题目
3.在浓度均为4mol•L-1的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2:3,则加入铁粉的质量是( )
| A. | 22.4 g | B. | 16.8 g | C. | 11.2 g | D. | 8.4 g |
10.下列各组离子,能在指定溶液中大量共存的是( )
| A. | 使pH试纸变深蓝色的溶液中:K+、CO32-、Na+、AlO2- | |
| B. | 1.0mol/LKNO3溶液:H+、Fe2+、Cl-、SO42- | |
| C. | 与铝反应产生H2的溶液中:Na+、Mg2+、HCO3-、SO42- | |
| D. | 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、I- |
20.下列关于物质的量浓度表述正确的是( )
| A. | 0.2mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL 2mol•L-1的NaCl溶液和100 mL L 0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol•L-1 | |
| D. | 10g 98%的硫酸(密度为1.84g•cm-3)与10mL 18.4mol•L-1的硫酸的浓度是相同的 |
7.常温下,某溶液中水电离出的H+浓度为1×10-13mol•L-1,有关该溶液的说法正确的是( )
| A. | 加入铝粉一定能产生大量H2 | |
| B. | 溶液中OH-的浓度一定为0.1mol•L-1 | |
| C. | 还可能大量存在Na+、NH4+‘Cl-、S2O32- | |
| D. | 通入少量 HCl 气体可能会使溶液中水的电离程度增大 |
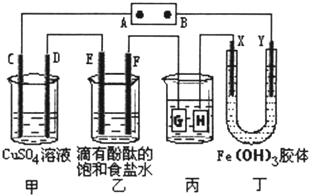 如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深.请回答:
如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深.请回答: