题目内容
3.一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)?CH3OH(g)达到平衡,已知Ⅰ中的反应经过40min后达到平衡,则下列说法正确的是( )| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | Ⅰ中反应在0-40min内的平均速率为v(H2)=0.0020mol•L-1•min-1 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 三个溶液中反应的平衡常数关系为Ⅱ=Ⅰ>Ⅲ | |
| D. | 若起始时向容器Ⅰ中充入0.020molH2、0.010molCO和0.010molCH3OH,则反应处于平衡状态 |
分析 对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH较低,说明升高温度平衡逆向移动,正反应为放热反应,对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式可知,增大浓度,平衡正向移动,以此解答该题.
解答 解:A.Ⅰ中反应在0-40min内v(CH3OH)=$\frac{0.080mol/L}{40min}$=0.0020mol•L-1•min-1,则v(H2)=0.0040mol•L-1•min-1,故A错误;
B.对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式2H2(g)+CO(g)?CH3OH(g)可知,增大浓度,平衡正向移动,该反应正向为体积减小的反应,增大浓度转化率会增大,则容器Ⅰ中反应物转化率比容器Ⅱ中的小,故B错误;
C.由以上分析可知,正反应为放热反应,则升高温度,平衡常数减小,Ⅱ=Ⅰ>Ⅲ,故C正确;
D.由Ⅰ可知K=$\frac{0.08}{0.1{2}^{2}×0.02}$=277.8,若起始时向容器Ⅰ中充入0.020molH2、0.010molCO和0.010molCH3OH,则Qc=$\frac{0.010}{0.02{0}^{2}×0.010}$=2500,没有达到平衡状态,故D错误.
故选C.
点评 本题考查了化学平衡的有关计算、化学反应速率的影响,涉及等效平衡问题,侧重于学生的分析能力的考查,题目难度中等,但易错,答题时注意把握反应的特点以及平衡的影响因素.

练习册系列答案
相关题目
19.在PH=1的溶液中,能大量共存的是( )
| A. | Fe2+、Cl-、NO3-、Na+ | B. | K+、Cu2+、SO42-、Cl- | ||
| C. | Na+、K+、CO32-、SO42- | D. | Mg2+、SO42-、OH-、NO3- |
14.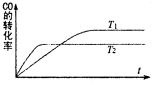 一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
 一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )| A. | T1>T2,该反应的△H>0 | |
| B. | 加入催化剂可以提高CO的转化率 | |
| C. | T1时的平衡常数K1大于T2时的平衡常数K2 | |
| D. | 温度降低,CO(g)+2H2(g)?CH3OH(l)的△H值将变大 |
18.化学与生活息息相关,下列说法正确的是( )
| A. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| B. | 医用消毒酒精中乙醇的浓度为95% | |
| C. | 加活性炭吸附水中小颗粒物,净化水质的方法属于物理方法 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,“硝”是指硝酸 |
8.下列关于浓硝酸和浓硫酸的叙述正确的是( )
| A. | 露置在空气中,容器内酸液的质量都减轻 | |
| B. | 常温下都能与铜较快反应 | |
| C. | 常温下都能与氨气反应 | |
| D. | 加热条件下都能与碳反应 |
12.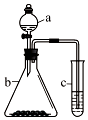 利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )
利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )
 利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )
利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )| 选项 | a | b | c | c试管中现象 |
| A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
| B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
| C | 硼酸 | Na2CO3 | Na2SiO3溶液 | 析出白色沉淀 |
| D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
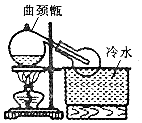 实验室常用浓H2SO4与NaNO3粉末反应制取HNO3,实验装置如图.
实验室常用浓H2SO4与NaNO3粉末反应制取HNO3,实验装置如图.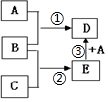 已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答:
已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答: