题目内容
11.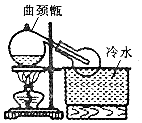 实验室常用浓H2SO4与NaNO3粉末反应制取HNO3,实验装置如图.
实验室常用浓H2SO4与NaNO3粉末反应制取HNO3,实验装置如图.(1)曲颈瓶的颈管的作用是避免橡胶被腐蚀.
(2)实验室用小火微热而不同大火加热的原因是易分解.
分析 硝酸的制取原理是:固体和液体微热制取,难挥发性的酸来制取挥发性的酸,且浓硝酸具有强氧化性和腐蚀性,不稳定,易分解,以此解答该题.
解答 解:(1)曲颈甑全是磨砂接口,用于制备硝酸,因硝酸具有强氧化性,可腐蚀橡胶,则制备硝酸用曲颈甑,可避免橡胶被腐蚀,
故答案为:避免橡胶被腐蚀;
(2)硝酸不稳定,在温度较高时易分解,制备时应用小火微热,故答案为:易分解.
点评 本题考查硝酸的性质,侧重于学生的分析能力和元素化合物知识的综合考查和运用,注意把握题给信息,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
7.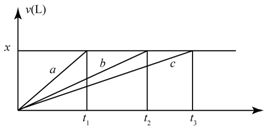 将等物质的量的金属Na、Mg、Al分别于100mL2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况),不正确的是( )
将等物质的量的金属Na、Mg、Al分别于100mL2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况),不正确的是( )
 将等物质的量的金属Na、Mg、Al分别于100mL2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况),不正确的是( )
将等物质的量的金属Na、Mg、Al分别于100mL2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况),不正确的是( )| A. | x=2.24 | B. | 钠的物质的量为0.2 mol | ||
| C. | 反应时,Na、Mg、Al均过量 | D. | 曲线b为Mg与盐酸反应的图象 |
19.在Al3++3H2O?Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动.且使溶液的pH增大,应采取的措施是( )
| A. | 加热 | B. | 通入HCl | ||
| C. | 加入适量的NaOH(固体) | D. | 加入固体NaCl |
3.一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)?CH3OH(g)达到平衡,已知Ⅰ中的反应经过40min后达到平衡,则下列说法正确的是( )
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | Ⅰ中反应在0-40min内的平均速率为v(H2)=0.0020mol•L-1•min-1 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 三个溶液中反应的平衡常数关系为Ⅱ=Ⅰ>Ⅲ | |
| D. | 若起始时向容器Ⅰ中充入0.020molH2、0.010molCO和0.010molCH3OH,则反应处于平衡状态 |
20.下列有关实验设计或操作正确且能达到目的是( )
| 选项 | A | B | C | D |
| 实验装置或操作 |  | 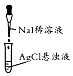 | 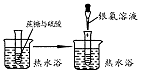 |  |
| 实验目的 | 配制一定物质的量浓度的稀硫酸 | 悬浊液由白色转为黄色证明Ksp(AgCl)大于Ksp(AgI) | 验证蔗糖在硫酸催化作用下发生水解反应 | 从碳酸氢钠悬浊液中分离出NaHCO3的晶体 |
| A. | A | B. | B | C. | C | D. | D |
1.NaCl是一种化工原料,可以制备一系列物质(见图).下列说法正确的是( )
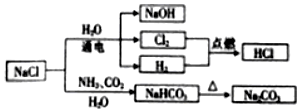
已知:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl.

已知:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl.
| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 图中所示转化反应都是氧化还原反应 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | H2与Cl2反应时产生苍白色火焰并形成白雾 |


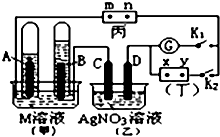 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题: