题目内容
14.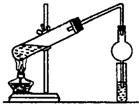 某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.
某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.(1)装置中干燥管的作用是防止小试管中液体发生倒吸
(2)小试管中的试剂加入顺序为B
A.浓硫酸 乙醇 乙酸 B.乙醇 浓硫酸 乙酸 C.乙酸 浓硫酸 乙醇.
分析 在大试管中先注入乙醇,再分别缓缓加入浓硫酸、乙酸(乙醇和浓硫酸的加入顺序不可互换),乙醇和乙酸在浓硫酸催化作用下生成乙酸乙酯,发生反应方程式为CH3COOH+C2H5OH  CH3COOC2H5+H2O,小试管中饱和碳酸钠溶液除去乙酸、吸收乙醇、降低乙酸乙酯的溶解度,则球形干燥管可防止液体倒吸,以此来解答.
CH3COOC2H5+H2O,小试管中饱和碳酸钠溶液除去乙酸、吸收乙醇、降低乙酸乙酯的溶解度,则球形干燥管可防止液体倒吸,以此来解答.
解答 解:(1)装置中干燥管的作用是防止小试管中液体发生倒吸,故答案为:防止小试管中液体发生倒吸;
(2)浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,则加入药品的顺序为先在大试管中注入乙醇,再分别缓缓加入浓硫酸和乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀,即加入顺序为乙醇、浓硫酸、乙酸,
故答案为:B.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验原理、物质的性质、实验技能等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
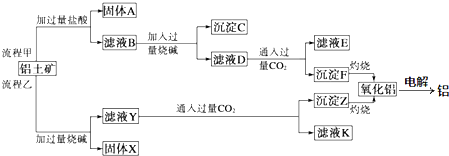
4.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、SiO${\;}_{3}^{2-}$.现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化.
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成.过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成.
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-.
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-${\;}_{3}^{-}$+OH--→AlO2-+NH3+N2+H2O(未配平).还原产物是NH3和N2.若除去0.2molNO3-,要消耗铝9.6g.
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理.下列处理措施和方法中正确的是AD.
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化.
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成.过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成.
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-.
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-${\;}_{3}^{-}$+OH--→AlO2-+NH3+N2+H2O(未配平).还原产物是NH3和N2.若除去0.2molNO3-,要消耗铝9.6g.
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理.下列处理措施和方法中正确的是AD.
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
2.一定温度下反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志是( )
| A. | 单位时间里每增加1molN2,同时减少2molNH3 | |
| B. | c(N2):c(H2):c(NH3)=1:1:1 | |
| C. | N2与H2的物质的量与NH3的物质的量相等 | |
| D. | N2、H2和NH3的质量分数不再改变 |
9.结合表回答下列问题:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:
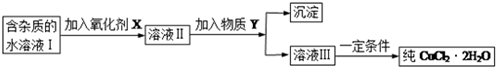
(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=4.0×10-8mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在HCl气氛中蒸发结晶.
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=4.0×10-8mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在HCl气氛中蒸发结晶.
19.下列各选项从左至右按互为同位素、互为同系物、互为同分异构体、互为同素异形体、是同种物质顺序排列的是( )
①C60、C70、金刚石、石墨
②C2H5OH、CH3OCH3
③${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$
④HOCH2COOH、HOCH2CH2COOH、HOCH2CH2CH2COOH
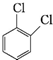
⑤ 、
、
①C60、C70、金刚石、石墨
②C2H5OH、CH3OCH3
③${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$
④HOCH2COOH、HOCH2CH2COOH、HOCH2CH2CH2COOH
⑤
 、
、
| A. | ①②③⑤④ | B. | ③⑤④①② | C. | ④②①⑤③ | D. | ③④②①⑤ |
6.下列物质中,不能使品红溶液褪色的是( )
| A. | 次氯酸 | B. | 活性炭 | C. | 二氧化碳 | D. | 二氧化硫 |
4.下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白
(1)这11种元素中化学性质最不活泼的是Ar,金属性最强的是K.(写元素符号)
(2)第三周期元素中,原子半径最大的元素是(稀有气体元素除外)Na,离子半径最小的是Al,单质氧化性最强的元素是Cl.(写元素符号)
(3)J的简单离子的结构示意图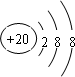 .
.
(4)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)KOH>NaOH>Mg(OH)2>Al(OH)3.
(5)比较G、H两元素的最高价氧化物对应水化物的酸性HClO4>H2SO4.比较C、G两元素的气态氢化物稳定性HCl>H2S.(写化学式)
(6)C和D的单质在点燃条件下生成化合物的电子式为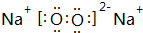 ,它属于离子(离子或共价)化合物.
,它属于离子(离子或共价)化合物.
(7)用电子式表示A和G所形成的简单化合物的形成过程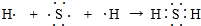 .
.
| 族 周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | O |
| 一 | A | |||||||
| 二 | B | C | ||||||
| 三 | D | E | F | G | H | I | ||
| 四 | K | J | ||||||
(2)第三周期元素中,原子半径最大的元素是(稀有气体元素除外)Na,离子半径最小的是Al,单质氧化性最强的元素是Cl.(写元素符号)
(3)J的简单离子的结构示意图
 .
.(4)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)KOH>NaOH>Mg(OH)2>Al(OH)3.
(5)比较G、H两元素的最高价氧化物对应水化物的酸性HClO4>H2SO4.比较C、G两元素的气态氢化物稳定性HCl>H2S.(写化学式)
(6)C和D的单质在点燃条件下生成化合物的电子式为
 ,它属于离子(离子或共价)化合物.
,它属于离子(离子或共价)化合物.(7)用电子式表示A和G所形成的简单化合物的形成过程
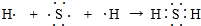 .
.