题目内容
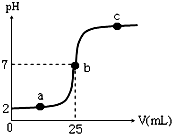 在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.
在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.(1)醋酸溶液浓度
(2)b点,c(Na+)
(3)当醋酸与氢氧化钠溶液恰好完全中和时,曲线上对应的点Q应在
A.2与a之间 B.a与b之间 C.b与c之间 D.a与c之间
(4)下列关系式一定正确的是
A.a点,c(H+)>c(OH-)>c(CH3COO-)>c(Na+)
B.a点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c点,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c点,c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
考点:中和滴定,离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:(1)弱电解质部分电离,已电离出氢离子浓度为0.01mol/L,故醋酸浓度大于0.01mol/L;
(2)根据电荷守恒分析;
(3)恰好完全中和生成醋酸钠,醋酸钠水解显碱性;
(4)a点,加入氢氧化钠较少,醋酸部分被中和,所得混合溶液是醋酸钠和醋酸的混合物;在c点,加入氢氧化钠较多,所得混合溶液是氢氧化钠和醋酸钠的混合物.
(2)根据电荷守恒分析;
(3)恰好完全中和生成醋酸钠,醋酸钠水解显碱性;
(4)a点,加入氢氧化钠较少,醋酸部分被中和,所得混合溶液是醋酸钠和醋酸的混合物;在c点,加入氢氧化钠较多,所得混合溶液是氢氧化钠和醋酸钠的混合物.
解答:
解:(1)弱电解质部分电离,从图象可知,pH=2,已电离出氢离子浓度为0.01mol/L,故醋酸浓度大于0.01mol/L;
故答案为:大于;弱电解质部分电离,已电离出氢离子浓度为0.01mol/L,故醋酸浓度大于0.01mol/L;
(2)根据电荷守恒得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),b点pH=7呈中性,则c(H+)=c(OH-),故c(CH3COO-)=c(Na+);
故答案为:=;
(3)恰好完全中和生成醋酸钠,醋酸钠水解显碱性,故Q位于b和c之间;
故答案为:C;
(4)a点,加入氢氧化钠较少,醋酸部分被中和,所得混合溶液是醋酸钠和醋酸的混合物,醋酸电离使溶液呈酸性,故c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A、B错误;在c点,加入氢氧化钠较多,所得混合溶液是氢氧化钠和醋酸钠的混合物,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),根据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故C、D正确;
故答案为:CD.
故答案为:大于;弱电解质部分电离,已电离出氢离子浓度为0.01mol/L,故醋酸浓度大于0.01mol/L;
(2)根据电荷守恒得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),b点pH=7呈中性,则c(H+)=c(OH-),故c(CH3COO-)=c(Na+);
故答案为:=;
(3)恰好完全中和生成醋酸钠,醋酸钠水解显碱性,故Q位于b和c之间;
故答案为:C;
(4)a点,加入氢氧化钠较少,醋酸部分被中和,所得混合溶液是醋酸钠和醋酸的混合物,醋酸电离使溶液呈酸性,故c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A、B错误;在c点,加入氢氧化钠较多,所得混合溶液是氢氧化钠和醋酸钠的混合物,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),根据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故C、D正确;
故答案为:CD.
点评:本题考查了中和滴定和离子浓度大小比较,中等难度.注意从图象获取信息,比较离子浓度大小时要考虑弱电解质的电离和离子的水解,同时考虑守恒的运用.

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
将30mL0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液的浓度为( )
| A、0.1mol/L |
| B、0.3mol/L |
| C、0.05mol/L |
| D、0.03mol/L |