题目内容
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.
已知Cl2+H2O=HCl+HClO.为了探究HClO的漂白性,某同学设计了如图的实验.
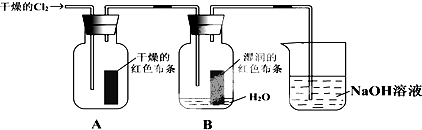
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ,从集气瓶B中湿润的红色布条的现象可得出的结论是 .
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是 .
(3)某化学兴趣小组计划用氯气和氢氧化钠溶液制取简易消毒液.
①其反应原理为:(用离子方程式表示)
②实验室配制好4.0mol?L-1的NaOH溶液,这种溶液 L才能与2.24L氯气(标准状况)恰好完全反应.
(4)配制250mL 4.0mol?L-1NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量.
b.称量氢氧化钠固体.
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶.
d.用适量蒸馏水溶解称量好的氧氧化钠固体,冷却.
e.盖好瓶塞,反复上下颠倒,摇匀.
f.继续向容量瓶中加蒸馏水至刻度线下1cm~2cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切.
上述步骤的正确操作顺序是 .
(5)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(6)若要配制480ml0.1mol?L-1的NaOH溶液,应选用 ml的容量瓶(填“100”或“250”或“500”),要用托盘天平称取NaOH固体 克.
已知Cl2+H2O=HCl+HClO.为了探究HClO的漂白性,某同学设计了如图的实验.

(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是
(3)某化学兴趣小组计划用氯气和氢氧化钠溶液制取简易消毒液.
①其反应原理为:(用离子方程式表示)
②实验室配制好4.0mol?L-1的NaOH溶液,这种溶液
(4)配制250mL 4.0mol?L-1NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量.
b.称量氢氧化钠固体.
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶.
d.用适量蒸馏水溶解称量好的氧氧化钠固体,冷却.
e.盖好瓶塞,反复上下颠倒,摇匀.
f.继续向容量瓶中加蒸馏水至刻度线下1cm~2cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切.
上述步骤的正确操作顺序是
(5)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(6)若要配制480ml0.1mol?L-1的NaOH溶液,应选用
考点:性质实验方案的设计,配制一定物质的量浓度的溶液,探究氯水、氯气的漂白作用
专题:
分析:(1)氯气不能时干燥红色布条褪色,说明氯气没有漂白性;氯气能使湿润的有色布条褪色,说明HClO有漂白性;
(2)氯气和水生成HCl和HClO,要排除HCl是否有漂白性,才能证明HClO是否有漂白性;
(3)氯气和NaOH溶液反应生成NaCl和NaClO;根据方程式中氯气和NaOH之间的关系式计算;
(4)配制一定物质的量浓度溶液的操作步骤是:计算、称量、溶解、转移、洗涤、定容、摇匀;
(5)根据C=
知,如果n偏大或V偏小都导致配制溶液浓度偏高;
(6)选取容量瓶规格应该等于或稍微大于配制溶液体积,根据m=CVM计算NaOH的质量.
(2)氯气和水生成HCl和HClO,要排除HCl是否有漂白性,才能证明HClO是否有漂白性;
(3)氯气和NaOH溶液反应生成NaCl和NaClO;根据方程式中氯气和NaOH之间的关系式计算;
(4)配制一定物质的量浓度溶液的操作步骤是:计算、称量、溶解、转移、洗涤、定容、摇匀;
(5)根据C=
| n |
| V |
(6)选取容量瓶规格应该等于或稍微大于配制溶液体积,根据m=CVM计算NaOH的质量.
解答:
解:(1)氯气不能时干燥红色布条褪色,说明氯气没有漂白性;氯气能使湿润的有色布条褪色,说明HClO有漂白性,发生的反应为Cl2+H2O=HCl+HClO,故答案为:氯气没有漂白性;HClO有漂白性;
(2)氯气和水发生的反应为Cl2+H2O=HCl+HClO,只有要排除HCl没有漂白性,才能证明HClO具有漂白性,所以要增加一个盐酸滴入有色布条的实验,故答案为:HCl能否使有色布条褪色;
(3)氯气和NaOH溶液反应生成NaCl和NaClO,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,次氯酸钠也有漂白性;
根据方程式中氯气和NaOH之间的关系式得n(NaOH)=2n(Cl2)=2×
=0.2mol,V(NaOH)=
=0.050L,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;0.05;
(4)配制一定物质的量浓度溶液的操作步骤是:计算、称量、溶解、转移、洗涤、定容、摇匀,所以其排列顺序是abdcfe,故答案为:abdcfe;
(5)根据C=
知,如果n偏大或V偏小都导致配制溶液浓度偏高,
A.定容时仰视容量瓶刻度线,导致溶液体积偏大,则配制溶液浓度偏低,故错误;
B.定容时俯视容量瓶刻度线,导致溶液体积偏小,则配制溶液浓度偏高,故正确;
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作,未洗涤烧杯和玻璃棒,会导致溶质的物质的量偏小,则配制溶液浓度偏低,故错误;
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,导致溶液体积偏大,则配制溶液浓度偏低,故错误;
故选B;
(6)选取容量瓶规格应该等于或稍微大于配制溶液体积,所以配制480mL溶液应该选取500mL容量瓶,m(NaOH)=CVM=0.1mol/L×0.5L×40g/mol=2.0g,故答案为:500;2.0g.
(2)氯气和水发生的反应为Cl2+H2O=HCl+HClO,只有要排除HCl没有漂白性,才能证明HClO具有漂白性,所以要增加一个盐酸滴入有色布条的实验,故答案为:HCl能否使有色布条褪色;
(3)氯气和NaOH溶液反应生成NaCl和NaClO,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,次氯酸钠也有漂白性;
根据方程式中氯气和NaOH之间的关系式得n(NaOH)=2n(Cl2)=2×
| 2.24L |
| 22.4L/mol |
| 0.2mol |
| 4.0mol/L |
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;0.05;
(4)配制一定物质的量浓度溶液的操作步骤是:计算、称量、溶解、转移、洗涤、定容、摇匀,所以其排列顺序是abdcfe,故答案为:abdcfe;
(5)根据C=
| n |
| V |
A.定容时仰视容量瓶刻度线,导致溶液体积偏大,则配制溶液浓度偏低,故错误;
B.定容时俯视容量瓶刻度线,导致溶液体积偏小,则配制溶液浓度偏高,故正确;
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作,未洗涤烧杯和玻璃棒,会导致溶质的物质的量偏小,则配制溶液浓度偏低,故错误;
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,导致溶液体积偏大,则配制溶液浓度偏低,故错误;
故选B;
(6)选取容量瓶规格应该等于或稍微大于配制溶液体积,所以配制480mL溶液应该选取500mL容量瓶,m(NaOH)=CVM=0.1mol/L×0.5L×40g/mol=2.0g,故答案为:500;2.0g.
点评:本题考查性质实验方案设计,涉及次氯酸的漂白性、溶液的配制等知识点,侧重考查学生实验操作、分析问题能力,明确物质的性质是解本题关键,会误差分析,注意容量瓶规格的选取方法,题目难度不大.

练习册系列答案
相关题目
下列事实,不能用勒夏特列原理解释的是( )
| A、实验室用排饱和食盐水而不用排水法收集氯气 |
| B、加催化剂,使N2和H2在一定条件下转化为NH3 |
| C、合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D、光照新制的氯水时,溶液中c(H+)增大 |
下列叙述或操作不正确的是( )
| A、向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌 |
| D、浓硫酸能与铜反应,说明浓硫酸有强氧化性 |
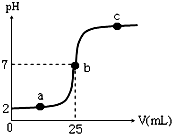 在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.
在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示. ).
).
 ,且无环状结构的同分异构体有
,且无环状结构的同分异构体有