题目内容
将6.5g锌投入200mL某浓度的稀盐酸中,锌和稀盐酸恰好完全反应.求:
(1)6.5g锌的物质的量;
(2)所用稀盐酸中HCl的物质的量浓度;
(3)反应中生成的H2在标准状况下的体积;
(4)向反应后的溶液中加水至500mL,求此时氯化锌的物质的量浓度.
(1)6.5g锌的物质的量;
(2)所用稀盐酸中HCl的物质的量浓度;
(3)反应中生成的H2在标准状况下的体积;
(4)向反应后的溶液中加水至500mL,求此时氯化锌的物质的量浓度.
考点:化学方程式的有关计算
专题:
分析:(1)根据n=
,计算6.50g锌的物质的量;
(2)根据方程式计算n(HCl),再利用c=
计算盐酸的物质的量浓度;
(3)根据方程式计算生成氢气的物质的量,再根据V=nVm计算氢气的体积;
(4)加水稀释物质的量不变,利用c=
计算盐酸的物质的量浓度.
| m |
| M |
(2)根据方程式计算n(HCl),再利用c=
| n |
| V |
(3)根据方程式计算生成氢气的物质的量,再根据V=nVm计算氢气的体积;
(4)加水稀释物质的量不变,利用c=
| n |
| V |
解答:
解:(1)6.50g锌的物质的量为:
=0.1mol;
答:6.50g锌的物质的量是0.1mol;
(2)令HCl的物质的量为nmol,则:
Zn+2HCl=ZnCl2+H2↑
65g 2mol
6.5g nmol
所以
=
解得n=0.2
故该盐酸的物质的量浓度为:
=1mol/L,
答:所用盐酸中HCl中的物质的量浓度为1mol/L;
(3)由化学方程式Zn+2HCl=ZnCl2+H2↑可知:n(H2)=n(Zn)=0.1 mol,所以氢气的体积为:0.1mol×22.4L/mol=2.24L,
答:反应中生成的H2在标准状况下所占的体积为2.24L;
(4)n(ZnCl2)=n(Zn)=0.1 mol,所以c(ZnCl2)=
=0.2mol/L,答:氯化锌的物质的量浓度为:0.2mol/L.
| 6.5g |
| 65g/mol |
答:6.50g锌的物质的量是0.1mol;
(2)令HCl的物质的量为nmol,则:
Zn+2HCl=ZnCl2+H2↑
65g 2mol
6.5g nmol
所以
| 65g |
| 6.5g |
| 2mol |
| nmol |
解得n=0.2
故该盐酸的物质的量浓度为:
| 0.2mol |
| 0.2L |
答:所用盐酸中HCl中的物质的量浓度为1mol/L;
(3)由化学方程式Zn+2HCl=ZnCl2+H2↑可知:n(H2)=n(Zn)=0.1 mol,所以氢气的体积为:0.1mol×22.4L/mol=2.24L,
答:反应中生成的H2在标准状况下所占的体积为2.24L;
(4)n(ZnCl2)=n(Zn)=0.1 mol,所以c(ZnCl2)=
| 0.1mol |
| 0.5L |
点评:本题考查根据方程式的计算、常用化学计量的有关计算,比较基础,注意基础知识的掌握与根据方程式计算的格式.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是:( )
| A、1mol蔗糖可水解生成2mol葡萄糖 |
| B、CH3-CH=CH-CH3与C3H6一定互为同系物 |
C、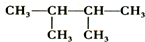 的名称是2,3-甲基丁烷 的名称是2,3-甲基丁烷 |
| D、乙醇可与水以任意比例混溶,是因为相似相溶原理且与水形成了氢键 |
在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )| A、原子半径:Y>Z>W |
| B、一定条件下,Y可置换出X |
| C、气态氢化物稳定性:Z>W |
| D、熔点YW2>XW4 |
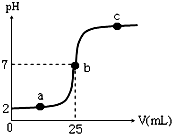 在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.
在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示. 浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器:
浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器: