题目内容
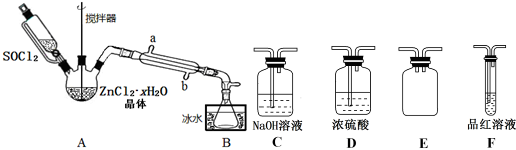
9. 如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.
如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.(1)按如图所示组装好仪器后,首先进行的操作是检查装置气密性.
(2)在带刻度的试管中加入一滴1%的酚酞溶液和足量的饱和碳酸钠溶液,并将其固定在铁架台上.请问饱和碳酸钠溶液的作用是吸收挥发出来的乙醇,中和乙酸和降低乙酸乙酯在水中的溶解度.
(3)在烧瓶中加入①5mL 37%的醋酸、②2mL酒精和③2mL浓硫酸以及几粒沸石.请问加入三种液体的顺序是②③①(请填序号).加入几粒沸石的作用是防止加热时溶液暴沸.
(4)圆底烧瓶中发生反应的化学方程式为:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(5)把干燥管处的塞子打开,停止加热,撤掉干燥管,可看到试管中呈现两层不同颜色的液体,上层液体无色.
分析 (1)乙酸、乙醇易挥发,为防止漏气,实验前先检验装置的气密性;
(2)饱和碳酸钠溶液可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;
(3)加入顺序为乙醇、浓硫酸、乙酸,提高乙酸的利用率;沸石可防止液体剧烈沸腾;
(4)乙酸和乙醇发生酯化反应生成乙酸乙酯和水,为可逆反应;
(5)乙酸乙酯与饱和碳酸钠溶液分层,且乙酸乙酯的密度比水的密度小.
解答 解:(1)按如图所示组装好仪器后,首先进行的操作是检查装置气密性,
故答案为:检查装置气密性;
(2)饱和碳酸钠溶液的作用是吸收挥发出来的乙醇,中和乙酸和降低乙酸乙酯在水中的溶解度,
故答案为:吸收挥发出来的乙醇,中和乙酸和降低乙酸乙酯在水中的溶解度;
(3)在烧瓶中加入①5mL 37%的醋酸、②2mL酒精和③2mL浓硫酸以及几粒沸石,加入三种液体的顺序是②③①.加入几粒沸石的作用是防止加热时溶液暴沸,
故答案为:②③①;防止加热时溶液暴沸;
(4)圆底烧瓶中发生反应的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(5)把干燥管处的塞子打开,停止加热,撤掉干燥管,可看到试管中呈现两层不同颜色的液体,上层为无色的乙酸乙酯,可知上层液体无色,
故答案为:无.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验操作、混合物分离提纯、有机物的性质为解答的关键,侧重分析与实验能力的考查,注意混合物的加入顺序,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
11.将5g 镁、锌、铁三种金属的混合物投入40mL稀硫酸中,恰好完全反应,生成的氢气在标准状况下的体积是2.8L,则这三种金属的物质的量之和为( )
| A. | 0.25mol | B. | 0.125mol | C. | 0.1mol | D. | 0.5mol |
12.下列关于铁与水反应的描述中,不正确的是( )
| A. | 铁与水蒸气反应的产物是黑色的Fe2O3 | |
| B. | 红热的铁能与水蒸气反应,放出的气体点燃时能发出爆鸣声 | |
| C. | 铁与水蒸气的反应是氧化还原反应 | |
| D. | 常温下,Fe与H2O不反应,但在空气中的O2、H2O共同作用下能发生反应 |
4.某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的两种仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(3)调节溶液PH为2~3的目的是防止在浓缩结晶过程中Ni2+水解.
(4)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.(回答一点即可)
(5)现有100千克含镍催化剂,如果酸浸步骤镍浸出率为a%,其它物质全部参与反应,且假定镍在酸浸后续步骤无损失.操作C后粗晶体中含绿矾b%,则最终能得到粗晶体$\frac{100×64.4%×a%×281}{(1-b%)×59}$千克(Ni-59 NiSO4•7H2O-281)(只要求写出计算表达式).若要进一步提纯晶体,需进行的操作是重结晶.

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的两种仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(3)调节溶液PH为2~3的目的是防止在浓缩结晶过程中Ni2+水解.
(4)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.(回答一点即可)
(5)现有100千克含镍催化剂,如果酸浸步骤镍浸出率为a%,其它物质全部参与反应,且假定镍在酸浸后续步骤无损失.操作C后粗晶体中含绿矾b%,则最终能得到粗晶体$\frac{100×64.4%×a%×281}{(1-b%)×59}$千克(Ni-59 NiSO4•7H2O-281)(只要求写出计算表达式).若要进一步提纯晶体,需进行的操作是重结晶.
18.下列各组物质的晶体中,化学键类型、分子极性及晶体类型均相同的是( )
| A. | SO2和SiO2 | B. | CO2和CH4 | C. | NaCl和HCl | D. | CCl4和H2O2 |