题目内容
17.二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解.(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为2:3:1.写出SOCl2吸收水蒸气的化学方程式:SOCl2+H2O=SO2↑+2HCl↑.
(2)甲同学设计如图装置用ZnCl2•xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):
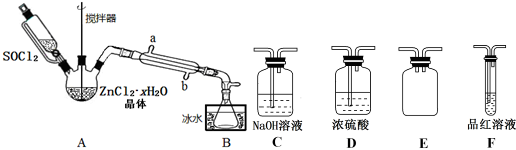
①装置的连接顺序为A→B→D→E→F→C.
②搅拌的作用是,冷凝管的进水口是b.(填“a”或“b”)
③实验结束后,为检测ZnCl2•xH2O晶体是否完全脱水,称取蒸干后的固体a g溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg.若 $\frac{b}{a}$=2.1(保留一位小数),即可证明ZnCl2•xH2O晶体已完全脱水.
④乙同学认为直接将ZnCl2•xH2O晶体置于坩埚中加热即可得到无水ZnCl2,但老师说此方法不可.请用化学方程式解释原因:不可行,因为ZnCl2加热时水解,反应方程式为ZnCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+ZnO+(x-1)H2O.
(3)丙同学认为SOCl2还可用作由FeCl3•6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应.请你设计并简述实验方案判断丁同学的观点:方法1:取少量FeCl3•6H2O于试管中,加入SOCl2,振荡;再往试管中加水溶解,然后滴加BaCl2溶液,若生成白色沉淀则证明脱水过程发生了氧化还原反应.
方法2:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象则证明脱水过程发生了氧化还原反应.
方法3:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀则证明脱水过程发生了氧化还原反应..
分析 (1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则反应的方程式为2S+3Cl2+SO3$\frac{\underline{\;一定条件\;}}{\;}$3SOCl2,根据方程式可知三者的物质的量比,SOCl2遇水剧烈反应生成SO2与HCl;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气种二氧化硫与HCl,防止污染环境,E装置防止倒吸;
②搅拌可以增大接触面积,加快反应速率;根据逆流冷却效果好进行判断;
③ZnCl2•xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,结合氯离子守恒计算;
④ZnCl2加热时会水解为氢氧化锌与HCl,氯化氢挥发,氢氧化锌受热分解为ZnO;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,可以检验硫酸根、亚铁离子或铁离子判断;
解答 解:(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则反应的方程式为2S+3Cl2+SO3$\frac{\underline{\;一定条件\;}}{\;}$3SOCl2,所以三者的物质的量比为2:3:1,SOCl2遇水剧烈反应生成SO2与HCl,反应方程式为:SOCl2+H2O=SO2↑+2HCl↑,
故答案为:2:3:1;SOCl2+H2O=SO2↑+2HCl↑;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气中二氧化硫与HCl,防止污染环境,E装置防止倒吸,装置的连接顺序为A→B→D→E→F→C,
故答案为:D,E,F,C;
②搅拌可以增大接触面积,加快脱水速率;逆流冷却效果好,应从b口进水,
故答案为:b;
③ZnCl2•xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,由氯离子守恒:$\frac{ag}{136g/mol}$×2=$\frac{bg}{143.5g/mol}$,整理可得$\frac{b}{a}$=2.1,
故答案为:2.1;
④ZnCl2加热时会水解为氢氧化锌与HCl,氯化氢挥发,氢氧化锌受热分解为ZnO,不能得到ZnCl2,该方案不可行,反应的方程式为ZnCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+ZnO+(x-1)H2O,
故答案为:不可行,因为ZnCl2加热时水解,反应方程式为ZnCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+ZnO+(x-1)H2O;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,实验证明脱水时发生了氧化还原反应方案为:
方法1:取少量FeCl3•6H2O于试管中,加入SOCl2,振荡;再往试管中加水溶解,然后滴加BaCl2溶液,若生成白色沉淀则证明脱水过程发生了氧化还原反应.
方法2:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象则证明脱水过程发生了氧化还原反应.
方法3:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀则证明脱水过程发生了氧化还原反应,
故答案为:方法1:取少量FeCl3•6H2O于试管中,加入SOCl2,振荡;再往试管中加水溶解,然后滴加BaCl2溶液,若生成白色沉淀则证明脱水过程发生了氧化还原反应.
方法2:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象则证明脱水过程发生了氧化还原反应.
方法3:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀则证明脱水过程发生了氧化还原反应.
点评 本题考查物质制备实验、实验方案设计、对原理与操作的分析与评价、化学计算等,关键是对实验原理的理解,较好地考查学生实验能力、计算能力、知识迁移运用能力,题目难度中等.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案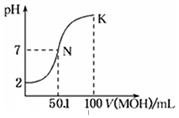 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )| A. | HA的电离方程式为:HA=H++A- | |
| B. | MOH为一元弱碱 | |
| C. | K点对应的溶液中有:c(MOH)+c(M+)=0.02mol•L-1 | |
| D. | N点对应的溶液中有:c(M+)=c(A-) |

已知:
生成氢氧化物沉淀的pH
| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化成MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为
5Mn2++2ClO${\;}_{3}^{-}$+□4H2O═□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生,其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).

可能用到的有关数据列表如下:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
(1)配制混酸应在烧杯中先加入浓硝酸;实验装置中长玻璃管最好用球形冷凝管(或蛇形冷凝管)代替(填仪器名称);恒压滴液漏斗的优点是使混合酸能顺利流下.
(2)反应温度控制在50~60℃的原因是防止副反应发生;反应结束后产物在下层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是分液.
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(4)固体D的名称为无水氯化钙或无水硫酸镁.
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为C6H5NO2+3Fe+6HCl→C6H5NH2+3FeCl2+2H2O.
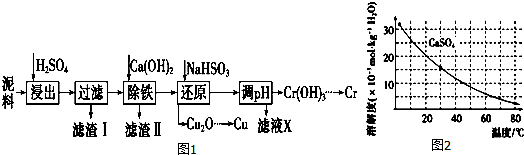
已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
4FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3═2NaAlO2+CO2↑.
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是使CrO42-转化为Cr2O72-.
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热浓缩、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
 如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.
如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.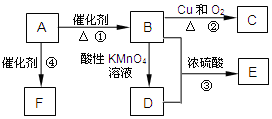 有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.
有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.