题目内容
11.将5g 镁、锌、铁三种金属的混合物投入40mL稀硫酸中,恰好完全反应,生成的氢气在标准状况下的体积是2.8L,则这三种金属的物质的量之和为( )| A. | 0.25mol | B. | 0.125mol | C. | 0.1mol | D. | 0.5mol |
分析 Mg、Zn、Fe与稀硫酸反应时都生成+2阳离子,根据电荷守恒可得关系式Mg(Zn、Fe)~H2,说明生成氢气的物质的量与金属总物质的量相等,根据n=$\frac{V}{{V}_{m}}$计算出氢气的物质的量即可得出这三种金属的物质的量之和.
解答 解:标准状况下2.8L氢气的物质的量为:$\frac{2.8L}{22.4L/mol}$=0.125mol,
Mg、Zn、Fe与稀硫酸反应时都生成+2阳离子,根据电荷守恒可知关系式Mg(Zn、Fe)~H2,说明金属的总物质的量与氢气的物质的量相等,所以这三种金属的物质的量之和为0.125mol,
故选B.
点评 本题考查了混合物反应的计算,题目难度不大,明确金属与氢气反应的关系式得出二者物质的量关系为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
20.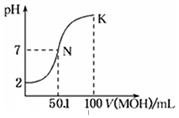 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )| A. | HA的电离方程式为:HA=H++A- | |
| B. | MOH为一元弱碱 | |
| C. | K点对应的溶液中有:c(MOH)+c(M+)=0.02mol•L-1 | |
| D. | N点对应的溶液中有:c(M+)=c(A-) |

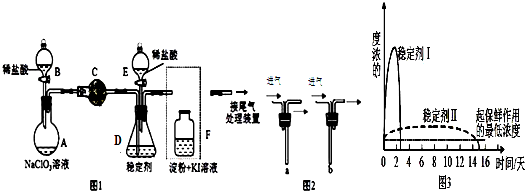
 如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.
如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.