题目内容
19.将54.4g铁和氧化铁的混合粉末投入足量的稀硫酸中全部溶解,充分反应后收集到4.48L H2(标准状况),所得溶液中加入KSCN溶液不出现血红色.求:(1)原混合物中Fe和Fe2O3各多少克?
(2)若反应的溶液的体积为200mL,则生成的溶质的物质的量浓度为多少?
分析 (1)将54.4g铁和氧化铁的混合粉末投入足量的稀硫酸中全部溶解,收集到标况下4.48L H2,当向溶液中滴几滴KSCN溶液时,溶液不显红色,说明最终得到硫酸亚铁,发生反应为Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,根据铁和稀硫酸反应方程式可知生成氢气消耗铁的物质的量,设铁的物质的量为x,氧化铁的物质的量为y,根据转移电子守恒及二者质量列方程计算原混合物中Fe和Fe2O3的质量;
(2)反应后溶液中的溶质为硫酸亚铁,根据Fe元素守恒可知硫酸亚铁的物质的量,然后根据c=$\frac{n}{V}$计算出生成的溶质的物质的量浓度.
解答 解:(1)将54.4g铁和氧化铁的混合粉末投入足量的稀硫酸中全部溶解,收集到标况下4.48L H2,当向溶液中滴几滴KSCN溶液时,溶液不显红色,说明最终得到硫酸亚铁,发生反应为Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,
生成氢气的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,根据反应Fe+2H+=Fe2++H2↑可知生成0.2mol氢气消耗Fe的物质的量为0.2mol,
设铁的物质的量为x,氧化铁的物质的量为y,
根据原混合物总质量可得:①56x+160y=54.4g,根据电子守恒可得:②2(x-0.2)=2y(3-2),
联立①②解得:x=0.4mol、y=0.2mol,
原混合物中Fe和Fe2O3的质量分别为:m(Fe)=56g/mol×0.4mol=22.4g,m(Fe2O3)=160g/mol×0.2mol=32g,
答:原混合物中Fe和Fe2O3的质量分别为22.4g、32g;
(2)反应后最终得到的为硫酸亚铁溶液,根据Fe元素守恒可知硫酸亚铁的物质的量为:0.4mol+0.2mol×2=0.8mol,
所以生成的溶质的物质的量浓度为:c=$\frac{0.8mol}{0.2L}$=4mol/L,
答:生成的溶质的物质的量浓度为4mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意根据守恒思想进行计算,试题培养了学生的化学计算能力.

 优学名师名题系列答案
优学名师名题系列答案| A. | 醋酸:一元强酸 | B. | Cl2:非电解质 | C. | CO2:电解质 | D. | NaHSO4:酸式盐 |
| A. | 同温同压下A、B两气体的密度之比为a:b | |
| B. | 同质量气体A与B的分子数之比为b:a | |
| C. | 两种气体A与B的相对分子质量之比为b:a | |
| D. | 相同状况下同体积A、B质量之比为a:b |
| 实验步骤 | 实验现象 |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
(1)实验目的:研究同主族元素性质递变规律.
(2)实验用品:试剂:氯水,溴水,NaBr溶液,KI溶液,CCl4溶液仪器:①试管,②胶头滴管.
(3)此实验的结论为氧化性的强弱顺序为:Cl2>Br2>I2.
(4)氯、溴、碘最高价氧化物对应的水化物酸性强弱(用分子式表示):HClO4>HBrO4>HIO4.
(5)氟、氯、溴、碘气态氢化物稳定性大小顺序(用分子式表示):HF>HCl>HBr>HI.
(6)该同学又做了另外一个实验,向新制得的Na2S溶液中滴加新制的氯水.该实验现象为生成淡黄色沉淀.此反应的离子方程式Cl2+S2-=S↓+2Cl-.此实验的结论为氧化性Cl2>S.
| A. | 此时水的转化率为71.4% | |
| B. | 此时CO2的体积分数为20.4% | |
| C. | 若再向容器内通入5mol H2O,则达到新平衡时,H2O的转化率升高 | |
| D. | 若从容器内移走5mol H2O,则达到新平衡时,CO的转化率升高 |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,正反应速率增大、逆反应速率减小 | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数变小 |
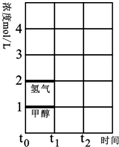 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ•mol-1、-283.0kJ•mol -1和-726.5kJ•mol-1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,5min达到平衡时测得c(CO)=0.2mol•L-1,此时的温度为250℃,则反应速率v(H2)=0.32 mol•L-1•min-1.
(3)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇).
 如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.
如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.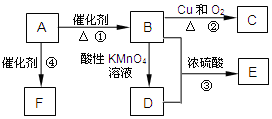 有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.
有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.