题目内容
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
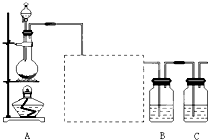
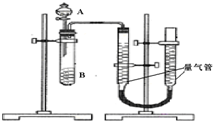
某同学进行实验,实验装置如右图.其中A、B的成分见下表
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(2)实验开始前需要检查气密性,其操作是
(3)完成该实验还需要
(4)请在框图中,画出实验②、③中CO2体积随时间变化的预期结果示意图.

乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率.
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
(6)2号反应中,H2C2O4的反应速率为
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据实验①②、①③中不同的物理量判断该实验目的;
(2)使装置内外形成气压差是气密性检查的常用手段;无论避免影响测定结果,分液漏斗中的A溶液不能逐滴加入;
(3)判断反应速率需要时间,用秒表计时;
(4)②中草酸浓度小于①,③中反应物浓度相同,但③中使用了催化剂,根据浓度、催化剂对反应速率的影响画出②、③中CO2体积随时间变化的示意图;
(5)探究浓度对反应速率的影响时,溶液的总体积都为20mL,据此判断X值;由于4号实验中高锰酸钾过量,则溶液没有褪色;
(6)根据n=cV计算出反应物的物质的量,然后根据不足量计算出反应消耗的草酸的物质的量,最后根据v=
计算出H2C2O4的反应速率.
(2)使装置内外形成气压差是气密性检查的常用手段;无论避免影响测定结果,分液漏斗中的A溶液不能逐滴加入;
(3)判断反应速率需要时间,用秒表计时;
(4)②中草酸浓度小于①,③中反应物浓度相同,但③中使用了催化剂,根据浓度、催化剂对反应速率的影响画出②、③中CO2体积随时间变化的示意图;
(5)探究浓度对反应速率的影响时,溶液的总体积都为20mL,据此判断X值;由于4号实验中高锰酸钾过量,则溶液没有褪色;
(6)根据n=cV计算出反应物的物质的量,然后根据不足量计算出反应消耗的草酸的物质的量,最后根据v=
| △c |
| △t |
解答:
解:(1)根据表中数据可知,实验①②探究的是浓度对反应速率的影响,实验①③探究的是催化剂对反应速率的影响,所以该实验的目的是探究温度、催化剂对反应速率的影响,
故答案为:探究草酸浓度和催化剂对化学反应速率的影响;
(2)检查该装置的气密性方法为:打开分液漏斗活塞,向量气管中加入水,使量气管左边液面和右边液面相平,关闭活塞,降低量气管,若两侧水面高度差不变,证明气密性好,若不能则说明气密性不好;
为了避免实验误差,实验过程中分液漏斗中的溶液A必须一次性加入,不能逐滴加入,
故答案为:打开分液漏斗活塞,向量气管中加入水,使量气管左边液面和右边液面相平,关闭活塞,降低量气管,若两侧水面高度差不变,证明气密性好,若不能则说明气密性不好;一次性;
(3)根据反应速率v=
可知,需要测定时间从而判断反应速率大小,需要用秒表计时;
实验结束后读数前需要移动量气管,使两个量气管的液面相平,其作用是使两个量气管的压强相等,避免产生压强差,影响测定结果,
故答案为:秒表;使两个量气管的压强相等,避免产生压强差,影响测定结果;
(4)实验②中其它量都与①相同,只有草酸的浓度小于①,则反应生成二氧化碳的速率小于①,反应结束时间大于①;
实验③中各物质的浓度都与实验①相同,而实验③中使用了催化剂,则反应速率大于①,反应结束时间小于①;
由于酸性高锰酸钾不足,则反应①②③生成的二氧化碳的体积都相等,
据此画出实验②、③中CO2体积随时间变化的示意图为: ,
,
故答案为: ;
;
(5)为了探究KMnO4与H2C2O4浓度对反应速率的影响,实验1-4中溶液的总体积应该为20,则X=20-10-5=5;根据反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O可知,10mL酸性高锰酸钾需要消耗10mL草酸溶液,所以实验4中高锰酸钾过量,导致溶液没有褪色,
故答案为:5;KMnO4溶液过量;
(6)2号实验中草酸的物质的量为:0.5mol/L×0.01L=0.005mol,高锰酸钾的物质的量为:0.2mol/L×0.005L=0.001mol,
根据反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O可知,高锰酸钾不足,所以反应中消耗的草酸的物质的量为:0.001mol×
=0.0025mol,
2号反应中,H2C2O4的反应速率为:v(H2C2O4)=
=0.00625mol/(L?s),
故答案为:0.00625mol/(L?s).
故答案为:探究草酸浓度和催化剂对化学反应速率的影响;
(2)检查该装置的气密性方法为:打开分液漏斗活塞,向量气管中加入水,使量气管左边液面和右边液面相平,关闭活塞,降低量气管,若两侧水面高度差不变,证明气密性好,若不能则说明气密性不好;
为了避免实验误差,实验过程中分液漏斗中的溶液A必须一次性加入,不能逐滴加入,
故答案为:打开分液漏斗活塞,向量气管中加入水,使量气管左边液面和右边液面相平,关闭活塞,降低量气管,若两侧水面高度差不变,证明气密性好,若不能则说明气密性不好;一次性;
(3)根据反应速率v=
| △c |
| △t |
实验结束后读数前需要移动量气管,使两个量气管的液面相平,其作用是使两个量气管的压强相等,避免产生压强差,影响测定结果,
故答案为:秒表;使两个量气管的压强相等,避免产生压强差,影响测定结果;
(4)实验②中其它量都与①相同,只有草酸的浓度小于①,则反应生成二氧化碳的速率小于①,反应结束时间大于①;
实验③中各物质的浓度都与实验①相同,而实验③中使用了催化剂,则反应速率大于①,反应结束时间小于①;
由于酸性高锰酸钾不足,则反应①②③生成的二氧化碳的体积都相等,
据此画出实验②、③中CO2体积随时间变化的示意图为:
 ,
,故答案为:
 ;
;(5)为了探究KMnO4与H2C2O4浓度对反应速率的影响,实验1-4中溶液的总体积应该为20,则X=20-10-5=5;根据反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O可知,10mL酸性高锰酸钾需要消耗10mL草酸溶液,所以实验4中高锰酸钾过量,导致溶液没有褪色,
故答案为:5;KMnO4溶液过量;
(6)2号实验中草酸的物质的量为:0.5mol/L×0.01L=0.005mol,高锰酸钾的物质的量为:0.2mol/L×0.005L=0.001mol,
根据反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O可知,高锰酸钾不足,所以反应中消耗的草酸的物质的量为:0.001mol×
| 5 |
| 2 |
2号反应中,H2C2O4的反应速率为:v(H2C2O4)=
| ||
| 20s |
故答案为:0.00625mol/(L?s).
点评:本题考查了探究温度、催化剂对反应速率的影响、化学反应速率的计算等知识,题目难度中等,注意掌握影响化学反应速率的因素,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力.

练习册系列答案
相关题目
下列离子或分子在溶液中能大量共存,但通入NO2后会发生化学反应且生成沉淀的一组是( )
| A、Ba2+、Na+、Cl-、HSO3- |
| B、NH4+、K+、ClO-、S2- |
| C、Cu2+、Fe2+、NO3-、SO42- |
| D、Ag+、Na+、NH3?H2O、SO42- |
在如图所示的装置中,烧瓶中盛有空气,广口瓶中盛放下列物质时可发生喷泉的选项是( )
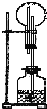

| A、块状大理石和稀硫酸 |
| B、NH4Cl与稀NaOH溶液 |
| C、Na2O2与NaOH溶液 |
| D、铜片与稀盐酸 |
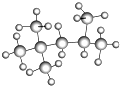 的名称(系统命名法)是
的名称(系统命名法)是