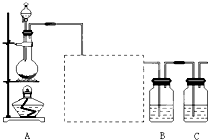
题目内容
在一定温度下,容积不变的密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),下列叙述不能认定该可逆反应已经达到平衡状态的是( )
| A、混合气体压强不再发生变化 |
| B、混合气体质量不再发生变化 |
| C、反应中CO与H2的物质的量之比为1:1 |
| D、生成nmolCO的同时生成nmolH2O |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答:
解:C(s)+H2O(g)?CO(g)+H2(g),
A.反应前后气体的体积不等,故混合气体压强不再发生变化可作为判断是否达到化学平衡状态的依据,故A不选;
B.反应前后气体的质量不等,故混合气体质量不再发生变化可作为判断是否达到化学平衡状态的依据,故B不选;
C.CO与H2的物质的量之比等于化学计量数之比=1:1,故反应中CO与H2的物质的量之比为1:1不能作为判断是否达到化学平衡状态的依据,故C可选;
D.生成nmolCO是正反应,同时生成nmolH2O是逆反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,达到平衡状态,故D不选,
故选C.
A.反应前后气体的体积不等,故混合气体压强不再发生变化可作为判断是否达到化学平衡状态的依据,故A不选;
B.反应前后气体的质量不等,故混合气体质量不再发生变化可作为判断是否达到化学平衡状态的依据,故B不选;
C.CO与H2的物质的量之比等于化学计量数之比=1:1,故反应中CO与H2的物质的量之比为1:1不能作为判断是否达到化学平衡状态的依据,故C可选;
D.生成nmolCO是正反应,同时生成nmolH2O是逆反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,达到平衡状态,故D不选,
故选C.
点评:本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
下列说法中,正确的是( )
| A、反应产物的总能量大于反应物的总能量时,△H<0 |
| B、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
| C、△H<0、△S>0的反应在温度低时不能自发进行 |
| D、一个化学反应的△H仅与反应的起始状态和反应的最终状态有关,与反应途径无关 |
下列电离方程式错误的是( )
| A、CaCl2=Ca2++2Cl- |
| B、Ba(OH)2=Ba2++2OH- |
| C、HNO3=H++NO3- |
| D、NaHCO3=Na++H++CO32- |
下列离子或分子在溶液中能大量共存,但通入NO2后会发生化学反应且生成沉淀的一组是( )
| A、Ba2+、Na+、Cl-、HSO3- |
| B、NH4+、K+、ClO-、S2- |
| C、Cu2+、Fe2+、NO3-、SO42- |
| D、Ag+、Na+、NH3?H2O、SO42- |
光导纤维被认为是20世纪最伟大的发明之一,它使信息高速公路在全球迅猛发展.光导纤维的主要成分是( )
| A、CaCO3 |
| B、Si |
| C、SiO2 |
| D、SiC |
常温熔融盐又称常温离子液体(ionic liquid),1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕,其熔点为12℃.已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是( )
| A、该离子液体中含氨分子 |
| B、硝酸乙基铵水溶液呈碱性 |
| C、硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++2H2O?C2H5NH2?H2O+H3O+ |
| D、同温度下相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH小 |