题目内容
14.已知:25℃时,A酸的溶液pH=a,B碱的溶液pH=b.(1)若A为强酸,B为强碱,且a+b=14,两者等体积混合后,此时若溶液中阳离子浓度大于阴离子浓度,其原因可能是酸为多元强酸;强酸强碱按体积比为1:10混合后溶液显中性,则a+b=13.
(2)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为R-+H2O?HR+OH-;
此混合溶液中,下列微粒浓度大小关系一定正确的是③⑤(填序号):
①c(MOH)>c(M+)>c (R-)>c (H+)>c (OH-)
②c (HR)>c (M+)>c (R-)>c (OH-)>c(H+)
③c (R-)>c(M+)>c (H+)>c (OH-)
④c (M+)>c (R-)>c (OH-)>c (H+)
⑤c (M+)+c (H+)=c (R-)+c (OH-)
分析 (1)酸中c(H+)=10-a mol/L,碱中c(OH-)=10 b-14 mol/L,根据混合溶液中氢离子浓度和氢氧根离子浓度的相对大小确定溶液的pH,溶液中阳离子浓度大于阴离子浓度,则酸为多元酸;强酸强碱按体积比为1:10混合后溶液显中性,以c酸V酸=c碱V碱计算;
(2)根据“pH之和为14的酸、碱溶液等体积混合,即n(H+)=n(OH-),混合后溶液显酸性,氢离子过量,则酸是弱酸;从盐类的水解以及电荷守恒角度分析.
解答 解:(1)酸中c(H+)=10-amol/L,碱中c(OH-)=10 b-14mol/L,且a+b=14,所以c(H+)=10-a mol/L=c(OH-)=10 b-14 mol/L,所以两种溶液等体积混合时,强酸强碱恰好中和,溶液呈中性,即pH=7,此时若溶液中阳离子浓度大于阴离子浓度,酸为多元酸,如反应生成硫酸钠;
强酸强碱按体积比为1:10混合后溶液显中性,由c酸V酸=c碱V碱可知,1×10-amol/L=10×10 b-14,mol/L,解得a+b=13,
故答案为:酸为多元强酸;13;
(2)由于混合溶液呈酸性,根据“pH之和为14的酸、碱溶液等体积混合,谁弱显谁性,无弱显中性”可判断HR一定是弱酸,则R-离子一定能发生水解,水解的离子方程式为:R-+H2O?HR+OH-;
由于溶液呈酸性,故c(H+)>c(OH-),排除②④;
根据c(H+)>c(OH-)和c(M+)+c(H+)=c(R-)+c(OH-)可得c(R-)>c(M+),则①错误,
由于OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(R-)>c(M+)>c(H+)>c(OH-),即③正确;
由电荷守恒可知⑤正确;
故答案为:R-+H2O?HR+OH-;③⑤.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,注意掌握盐的水解原理及其影响,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.

| A. | 元素周期表中查得的相对原子质量为同使素的相对原子质量 | |
| B. | 化学键的变化一定会引起化学反应的变化 | |
| C. | 酸性氧化物一定是非金属氧化物 | |
| D. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
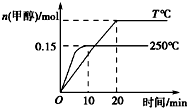 将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol,根据图示判断,下列结论正确的是( )
将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol,根据图示判断,下列结论正确的是( )| A. | a<0,T<250 | |
| B. | 250℃时,0~10 min内v(H2)=0.015 mol/(L•min) | |
| C. | CO的平衡转化率在250℃时比T℃时大 | |
| D. | 250℃时,起始时向容器中改充1 mol CH3OH气体,恒温达平衡后,CH3OH的物质的量大于0.15 mol |
| A. | 还原性Na>Mg>Al | B. | 氧化性Cl2>S>P | ||
| C. | 酸性H2SO4>H3PO4>HClO4 | D. | 稳定性HCl>H2S>PH3 |
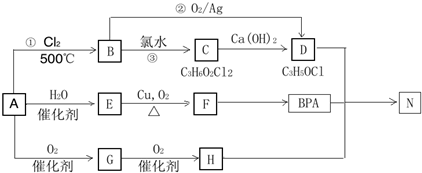

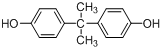
 .
.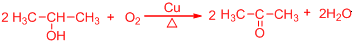 .
.
 .
.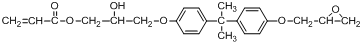
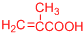 (或
(或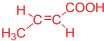 、
、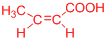 ).
).