题目内容
20.25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3•H2O的电离平衡常数为1.0×10-5.向此溶液中加入少量的氯化铵固体,此时$\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$值将增大(填“增大”,“减小”或“不变”).分析 根据氨水电离生成等量的铵根离子和氢氧根离子,求出平衡时各离子的浓度,再利用电离平衡常数的公式求解;溶液中加入少量的氯化铵固体,铵根离子浓度增大,溶液中OH-的浓度变化不大.
解答 解:.1mol/L氨水20.0mL,测得PH=11,则c(H+)=10-11 mol•L-1,所以c(0H-)=10-3mol•L-1,c(NH4+)=c(0H-)=10-3mol•L-1,
则Kb=$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1-1{0}^{-3}}$≈1.0×10-5;
溶液中加入少量的氯化铵固体,铵根离子浓度增大,溶液中OH-的浓度变化不大,所以$\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$值将增大;
故答案为:1.0×10-5;增大.
点评 本题考查了弱电解质的电离常数的计算,题目难度不大,侧重于考查学生的分析能力和计算能力,注意把握电离常数的计算公式.

练习册系列答案
相关题目
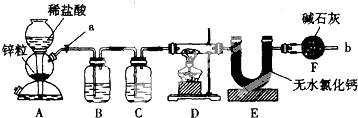
8.在温度T1和T2时,分别将0.50mol CH4和1.20mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)??N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
下列说法正确的是( )
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T2时CH4的平衡转化率为70.0% | |
| B. | 该反应的△H>0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 |
15.已知:常温下,Ksp(BaCO3)=2.5×10-9; Ksp(BaSO4)=1×10-10.现将0.5mol BaSO4放入1L 1.0mol•L-1 Na2CO3溶液中,反应一段时间达到平衡(不考虑溶液体积变化),下列说法不正确的是( )
| A. | Na2CO3溶液中:2c(H2CO3)+c(HCO3-)+c(H+)=c(OH-) | |
| B. | 该沉淀转化反应的平衡常数约为25 | |
| C. | 约有0.04 mol BaSO4溶解 | |
| D. | 反应后溶液中:c(Na+)>c (CO32-)>c(SO42-)>c(Ba2+) |
12.可以证明次氯酸是弱酸的事实是( )
| A. | 可以和碱反应 | B. | 次氯酸具有漂白性 | ||
| C. | 次氯酸不稳定、见光易分解 | D. | 次氯酸钙可和碳酸反应 |
9.下列有关元素的性质及其递变规律正确的是( )
| A. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| B. | 同主族元素的简单阴离子还原性越强,其氢化物越稳定 | |
| C. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| D. | IA族与ⅦA族元素间能形成离子化合物或共价化合物 |
 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为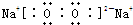 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. .
. 如图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液中S2-浓度,金属阳离子浓度变化情况.如果向含有这三种沉淀的混合物中加盐酸,最先溶解的是FeS.
如图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液中S2-浓度,金属阳离子浓度变化情况.如果向含有这三种沉淀的混合物中加盐酸,最先溶解的是FeS.