题目内容
17.含气体杂质的乙炔4.16g与H2加成生成饱和链烃,共用去4.48L(标准状况)H2,则气体杂质不可能是( )| A. | 乙烯 | B. | 丙炔 | C. | 丁二烯 | D. | 甲烷 |
分析 这道题可运用极值法:标准状况下4.48LH2物质的量为0.2mol,分别仅与四个选项(杂质)反应时,消耗量分别是:甲烷不反应,可视消耗甲烷无穷多,乙烯5.6g,丙炔4g,1,3-丁二烯5.4g,而氢气单独与乙炔反应时消耗乙炔2.6g,而4<4.16,2.6<4.16,因此气体杂质不可能是丙炔.
解答 解:标准状况下4.48LH2物质的量为0.2mol,分别仅与四个选项(杂质)反应时,消耗量分别是:甲烷不反应,可视消耗甲烷无穷多,乙烯5.6g,丙炔4g,1,3-丁二烯5.4g,而氢气单独与乙炔反应时消耗乙炔2.6g,而4<4.16,2.6<4.16,因此气体杂质不可能是丙炔,故选B.
点评 本题是考查学生运用极值法解题,极值法对于解决一些与量有关的问题是十分简捷,比较容易.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
8.将0.1mol/L醋酸溶液加水稀释,下列说法正确的是( )
| A. | 溶液中c(OH-)和c(H+)都减小 | B. | 溶液的PH增大 | ||
| C. | 醋酸电离平衡向左移动 | D. | 溶液中c(H+)增大 |
5.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、I- | |
| B. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| C. | 常温下,在c(H+)/c(OH-)=1×1012的溶液:NH4+、Mg2+、C1-、K+ | |
| D. | 水电离的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
2.容量瓶上需标有以下5项中的哪些内容?①温度 ②浓度 ③容量 ④压强 ⑤刻度线( )
| A. | ①③⑤ | B. | ③④⑤ | C. | ①②④ | D. | ②③④ |
9.从1L H2SO4溶液A中取出100mL,然后将此100mL溶液稀释得到400mL 0.01mol•L-1 H2SO4溶液B,则H2SO4溶液A的物质的量浓度为( )
| A. | 0.01mol•L-1 | B. | 0.04mol•L-1 | C. | 0.08mol•L-1 | D. | 0.16mol•L-1 |
11.如表列出了①~⑩十种元素在周期表中前四周期的位置,请回答下列问题:(填元素符号或化学式)
(1)在这十种元素形成的单质中化学性质最不活泼的是Ar;金属性最强的是K;非金属性最强的是E;能导电的单质有5种.
(2)①、③两元素的氧化物对应的水化物中碱性强的是NaOH;(填化学式,下同.)⑤、⑦两元素的最高价氧化物对应的水化物中酸性强的是H2SO4,用一个化学方程式证明Na2CO3+H2SO4=CO2↑+Na2SO4+H2O.
(3)①、②、③三元素按原子半径由小到大的顺序排列为Mg<Na<K.
(4)写出由②、⑨两元素组成物质的电子式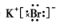 .
.
(5)①的氧化物对应的水化物与④的氯化物反应的离子方程式,因物质的量配比不同产物有所不同,试分别写出有关反应的离子方程式Al3++3OH-=Al(OH)3↓、Al3++4OH-=AlO2-+2H2O.
| 主族族数 周期序数 | ||||||||
| ⑤ | ⑥ | ⑧ | ||||||
| ① | ③ | ④ | ⑦ | ⑩ | ||||
| ② | ⑨ |
(2)①、③两元素的氧化物对应的水化物中碱性强的是NaOH;(填化学式,下同.)⑤、⑦两元素的最高价氧化物对应的水化物中酸性强的是H2SO4,用一个化学方程式证明Na2CO3+H2SO4=CO2↑+Na2SO4+H2O.
(3)①、②、③三元素按原子半径由小到大的顺序排列为Mg<Na<K.
(4)写出由②、⑨两元素组成物质的电子式
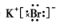 .
.(5)①的氧化物对应的水化物与④的氯化物反应的离子方程式,因物质的量配比不同产物有所不同,试分别写出有关反应的离子方程式Al3++3OH-=Al(OH)3↓、Al3++4OH-=AlO2-+2H2O.
12.下列有关金属腐蚀与保护的说法正确的是( )
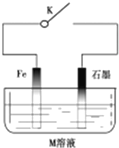

| A. | 常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀 | |
| B. | 关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑ | |
| D. | 关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法 |