题目内容
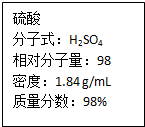 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓硫酸中H2SO4的物质的量浓度为
(2)该学生需要量取
(3)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能
用一次)
A.用30mL蒸馏水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓硫酸的体积,慢慢沿杯壁注入盛有少量蒸馏水的烧杯中,用玻璃
棒慢慢搅动,使其混合均匀
C.将已冷却的硫酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线
(4)在配制过程中,下列实验操作会使所配制的稀硫酸的物质的量浓度偏高的是
A.摇匀后静置,发现液面低于刻线,继续加水至与刻线相切
B.量取浓硫酸时俯视读数
C.定容时仰视读数
D.在配制前用已知浓度的稀硫酸润洗容量瓶
E.洗涤量取浓硫酸的量筒,并将洗涤液一并转入烧杯中
F.溶液没有恢复到室温就进行定容
(5)检验SO42-的试剂
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据c=
计算出浓硫酸的物质的量浓度;
(2)配制450mL物质的量浓度为0.1mol/L稀硫酸,需要选用500mL容量瓶,根据500mL 0.1mol/L稀硫酸中含有硫酸的物质的量计算出需要浓硫酸的体积;
(3)根据配制一定物质的量浓度的溶液方法对各操作进行排序;根据正确的定容方法进行解答;
(4)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(5)检验硫酸根离子,需要排除银离子的干扰,所以选用试剂为盐酸和氯化钡溶液,根据反应写出反应的现象.
| 1000ρw |
| M |
(2)配制450mL物质的量浓度为0.1mol/L稀硫酸,需要选用500mL容量瓶,根据500mL 0.1mol/L稀硫酸中含有硫酸的物质的量计算出需要浓硫酸的体积;
(3)根据配制一定物质的量浓度的溶液方法对各操作进行排序;根据正确的定容方法进行解答;
(4)根据c=
| n |
| V |
(5)检验硫酸根离子,需要排除银离子的干扰,所以选用试剂为盐酸和氯化钡溶液,根据反应写出反应的现象.
解答:
解:(1)该浓硫酸的物质的量浓度为:c=
mol/L=18.4mol/L,
故答案为:18.4 mol/L;
(2)配制450mL溶液,需要500mL容量瓶,配制500mL 0.1mol/L的稀硫酸,需要浓硫酸的体积为:
≈0.0027L=2.7mL,
故答案为:2.7;
(3)配制500mL 0.1mol/L的稀硫酸的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,正确的操作顺序为:BCAFED;
最后定容时需要改用胶头滴管进行定容;
转移完溶液后,先直接加入蒸馏水至距离容量瓶刻度线1-2cm,再改用胶头滴管定容,
故答案为:BCAFED;胶头滴管;1-2cm;
(4)A.摇匀后静置,发现液面低于刻线,继续加水至与刻线相切,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低,故A错误;
B.量取浓硫酸时俯视读数,导致量取浓硫酸体积偏小,配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故B错误;
C.定容时仰视读数,导致加入的蒸馏水体积偏大,配制溶液浓度偏低,故C错误;
D.在配制前用已知浓度的稀硫酸润洗容量瓶,导致配制的溶液中溶质的物质的量偏大,配制的溶液浓度偏高,故D正确;
E.洗涤量取浓硫酸的量筒,并将洗涤液一并转入烧杯中,量筒不需要洗涤,否则导致量取的浓硫酸体积偏大,配制的溶液浓度偏高,故E正确;
F.溶液没有恢复到室温就进行定容,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液浓度偏高,故F正确;
故答案为:DEF;
(5)检验硫酸根离子时,先加入盐酸无沉淀,排除银离子的干扰,然后再加入氯化钡溶液有白色沉淀生成,该白色沉淀为硫酸钡,则说明溶液中含有硫酸根离子,
故答案为:HCl溶液,BaCl2;先加入盐酸无沉淀,再加入氯化钡溶液有白色沉淀生成,说明含有硫酸根离子.
| 1000×1.84×98% |
| 98 |
故答案为:18.4 mol/L;
(2)配制450mL溶液,需要500mL容量瓶,配制500mL 0.1mol/L的稀硫酸,需要浓硫酸的体积为:
| 0.1mol/L×0.5L |
| 18.4mol/L |
故答案为:2.7;
(3)配制500mL 0.1mol/L的稀硫酸的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,正确的操作顺序为:BCAFED;
最后定容时需要改用胶头滴管进行定容;
转移完溶液后,先直接加入蒸馏水至距离容量瓶刻度线1-2cm,再改用胶头滴管定容,
故答案为:BCAFED;胶头滴管;1-2cm;
(4)A.摇匀后静置,发现液面低于刻线,继续加水至与刻线相切,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低,故A错误;
B.量取浓硫酸时俯视读数,导致量取浓硫酸体积偏小,配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故B错误;
C.定容时仰视读数,导致加入的蒸馏水体积偏大,配制溶液浓度偏低,故C错误;
D.在配制前用已知浓度的稀硫酸润洗容量瓶,导致配制的溶液中溶质的物质的量偏大,配制的溶液浓度偏高,故D正确;
E.洗涤量取浓硫酸的量筒,并将洗涤液一并转入烧杯中,量筒不需要洗涤,否则导致量取的浓硫酸体积偏大,配制的溶液浓度偏高,故E正确;
F.溶液没有恢复到室温就进行定容,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液浓度偏高,故F正确;
故答案为:DEF;
(5)检验硫酸根离子时,先加入盐酸无沉淀,排除银离子的干扰,然后再加入氯化钡溶液有白色沉淀生成,该白色沉淀为硫酸钡,则说明溶液中含有硫酸根离子,
故答案为:HCl溶液,BaCl2;先加入盐酸无沉淀,再加入氯化钡溶液有白色沉淀生成,说明含有硫酸根离子.
点评:本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
信息、材料和能源被称为新科技革命的三大支柱.下列有关说法错误的是( )
| A、复合材料保持了原材料的优点,又有优于原材料的特点 |
| B、玻璃钢是一种新型合金材料,其强度和韧性都强于钢铁 |
| C、“神六”飞船使用了大量的复合材料 |
| D、铜是一种有色金属材料 |
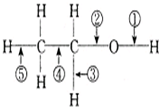 乙醇在一定条件下发生化学反应时化学键断裂如下图所示.下列说法不正确的是( )
乙醇在一定条件下发生化学反应时化学键断裂如下图所示.下列说法不正确的是( )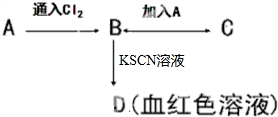 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系.
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系. (1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量. 工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.
工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.