题目内容
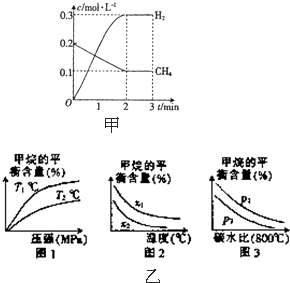 工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.
工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.(1)已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(g)△H=-1302.6kJ?mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
则天然气与水蒸气在高温下反应制备合成气的热化学方程式为
(2)在一定条件下,向2L的恒容密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间的变化曲线如图甲所示.
①0~2min内,一氧化碳的平均反应速率
v(CO)=
②3min时改变条件.反应进行到4min时,体系中各物质的物质的量如下表所示:
| t/min | n(CH4)/mol | n(H20)/mol | n(CO)/mol | n(H2)/mol |
| 4 | 0.18 | 0.38 | 0.22 | 0.66 |
(3)已知温度、压强和碳水比[n(CH4):n(H2O)=x]对该反应的影响如图乙
①图乙1中,两条曲线所示温度的关系:T1
②图乙2中,两条曲线所示碳水比(x)的关系:x1
③图乙3中,两条曲线所示压强的关系:p1
考点:热化学方程式,反应速率的定量表示方法,化学平衡的影响因素,产物的百分含量随浓度、时间的变化曲线
专题:基本概念与基本理论
分析:(1)根据燃烧热写出热化学方程式,利用盖斯定律计算;
(2)①依据图象计算甲烷的反应速率,结合反应速率之比等于化学方程式计量数之比计算得到一氧化碳的反应速率;
②根据图象可知3min时,平衡时各组分的平衡浓度,再根据4min时各组分浓度变化量判断改变的条件;
(3)①根据反应的热效应判断温度对平衡移动的影响,结合图象分析解答;
②碳水比[
]值越大,平衡时甲烷的转化率越低,含量越高;
③根据压强对平衡移动影响,结合图象分析解答.
(2)①依据图象计算甲烷的反应速率,结合反应速率之比等于化学方程式计量数之比计算得到一氧化碳的反应速率;
②根据图象可知3min时,平衡时各组分的平衡浓度,再根据4min时各组分浓度变化量判断改变的条件;
(3)①根据反应的热效应判断温度对平衡移动的影响,结合图象分析解答;
②碳水比[
| n(CH4) |
| n(H2O) |
③根据压强对平衡移动影响,结合图象分析解答.
解答:
解:(1)已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(g)△H=-1302.6kJ?mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
依据盖斯定律计算(①-②×3)×
得到天然气与水蒸气在高温下反应制备合成气的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+74.1 kJ?mol-1;
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+74.1 kJ?mol-1;
(2)①0~2min内,V(CH4)=
=0.05mol/L?min;
一氧化碳的平均反应速率v(CO)=V(CH4)=0.05mol/L?min,
故答案为:0.05;
②根据图象可知3min时,平衡时甲烷的浓度为0.1mol/L,氢气的浓度为0.3mol/L,则:
CH4(g)+H2O(g)=CO(g)+3H2(g)
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时甲烷的浓度为0.09mol/L,浓度减小0.1-0.09=0.01
水的浓度为0.19mol,浓度减小0.2-0.19=0.01;
CO的浓度为0.11,浓度增大0.11-0.1=0.01
氢气的浓度为0.33,浓度增大0.33-0.3=0.03
浓度变化量之比为1:1:1:3,等于化学计量数之比,应是改变温度平衡向正反应方向移动,该反应正反应是吸热反应,故3min改变条件为升高温度;
故答案为:正反应;升高温度;
(3)①该反应正反应为吸热反应,升高温度平衡向正反应方向移动,甲烷的含量降低,故温度T1<T2,故答案为:<;
②碳水比[
]值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
③该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量降低,故p1>p2,故答案为:>.
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
依据盖斯定律计算(①-②×3)×
| 1 |
| 2 |
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+74.1 kJ?mol-1;
(2)①0~2min内,V(CH4)=
| 0.2mol/L-0.1mol/L |
| 2min |
一氧化碳的平均反应速率v(CO)=V(CH4)=0.05mol/L?min,
故答案为:0.05;
②根据图象可知3min时,平衡时甲烷的浓度为0.1mol/L,氢气的浓度为0.3mol/L,则:
CH4(g)+H2O(g)=CO(g)+3H2(g)
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时甲烷的浓度为0.09mol/L,浓度减小0.1-0.09=0.01
水的浓度为0.19mol,浓度减小0.2-0.19=0.01;
CO的浓度为0.11,浓度增大0.11-0.1=0.01
氢气的浓度为0.33,浓度增大0.33-0.3=0.03
浓度变化量之比为1:1:1:3,等于化学计量数之比,应是改变温度平衡向正反应方向移动,该反应正反应是吸热反应,故3min改变条件为升高温度;
故答案为:正反应;升高温度;
(3)①该反应正反应为吸热反应,升高温度平衡向正反应方向移动,甲烷的含量降低,故温度T1<T2,故答案为:<;
②碳水比[
| n(CH4) |
| n(H2O) |
③该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量降低,故p1>p2,故答案为:>.
点评:本题综合性较大,涉及热化学方程式书写、化学平衡图象、化学平衡的影响因素、化学平衡计算、化学计算、离子浓度比较等,难度中等,是对基础知识与学生能力的综合考查.

练习册系列答案
相关题目
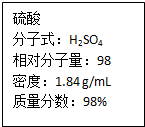 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: 金属(M)的腐蚀是因为发生反应:M-ne-→Mrn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属(M)的腐蚀是因为发生反应:M-ne-→Mrn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大. 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
 (一)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(一)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题: