题目内容
 (1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.①写出热化学方程式
②已知H2O(1)=H2O(g)△H=+44kJ/mol,则64g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
(2)已知拆开1molN≡N键,1molH-H键,1molN-H键分别需要的能量是a kJ、b kJ、c kJ,则N2与H2反应生成NH3的热化学方程式为:
(3)已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ?mol-1①
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-543kJ?mol-1②
| 1 |
| 2 |
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
①写出肼(N2H4)和NO2反应的热化学方程式
②有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为
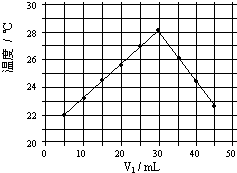
(4)将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).填写下列空白:
①做该实验时环境温度
②NaOH溶液的浓度约为
考点:热化学方程式,有关反应热的计算,用盖斯定律进行有关反应热的计算
专题:
分析:(1)①根据热化学方程式的书写方法,标注物质聚集状态和计算对应反应的焓变写出;
②根据盖斯定律结合热化学方程式来书写;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)①依据热化学方程式和盖斯定律计算得到;
②依据热化学方程式,结合目标热化学方程式,利用盖斯定律计算得到;
(4)①从图示观察的起始温度即为实验时的温度;
②由图可知,恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL可知,消耗的氢氧化钠溶液的体积为20mL,以此求出两者的体积比值、计算NaOH浓度.
②根据盖斯定律结合热化学方程式来书写;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)①依据热化学方程式和盖斯定律计算得到;
②依据热化学方程式,结合目标热化学方程式,利用盖斯定律计算得到;
(4)①从图示观察的起始温度即为实验时的温度;
②由图可知,恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL可知,消耗的氢氧化钠溶液的体积为20mL,以此求出两者的体积比值、计算NaOH浓度.
解答:
解:(1)①0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=641.625 kJ?mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1;
②因①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1,②H2O(l)═H2O(g)△H=+44kJ?mol-1,根据盖斯定律,①-②×4,得N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ?mol-1,所以64g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量为1635.25kJ,
故答案为:1635.25;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×bkJ+akJ=(a+3b)kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×ckJ=6ckJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为=(a+3b)kJ-6ckJ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-(6c-a-3b)kJ?mol-1;
(3)①由热化学方程式和盖斯定律可知,
①N2(g)+2O2(g)=2NO2(g)△H=67.7kJ?mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ?mol-1
依据盖斯定律②×2-①得到,2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.7kJ?mol-1;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.7kJ?mol-1 ;
②由已知热化学方程式和盖斯定律可知,
①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ?mol-1
②
H2(g)+
F2(g)=HF(g)△H=-269kJ?mol-1
③H2(g)+
O2(g)=H2O(g)△H=-242kJ?mol-1
依据盖斯定律①-③×2+②×4得到:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ?mol-1;
故答案为:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ?mol-1;
(4)①根据实验结果图2所示内容,可以知道该实验开始时温度一定是低于22℃,故答案为:<;
②恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL,消耗的氢氧化钠溶液的体积为20mL,所以V1/V2=3/2;
设恰好反应时氢氧化钠溶液中溶质的物质的量是n.
HCl+NaOH═NaCl+H2O
1 1
1.0mol?L-1×0.03L n
则n=1.0mol?L-1×0.03L=0.03mol,
所以浓度C=
=1.5mol/L;
故答案为:1.5.
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1;
②因①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1,②H2O(l)═H2O(g)△H=+44kJ?mol-1,根据盖斯定律,①-②×4,得N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ?mol-1,所以64g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量为1635.25kJ,
故答案为:1635.25;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×bkJ+akJ=(a+3b)kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×ckJ=6ckJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为=(a+3b)kJ-6ckJ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-(6c-a-3b)kJ?mol-1;
(3)①由热化学方程式和盖斯定律可知,
①N2(g)+2O2(g)=2NO2(g)△H=67.7kJ?mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ?mol-1
依据盖斯定律②×2-①得到,2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.7kJ?mol-1;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.7kJ?mol-1 ;
②由已知热化学方程式和盖斯定律可知,
①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ?mol-1
②
| 1 |
| 2 |
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
依据盖斯定律①-③×2+②×4得到:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ?mol-1;
故答案为:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ?mol-1;
(4)①根据实验结果图2所示内容,可以知道该实验开始时温度一定是低于22℃,故答案为:<;
②恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL,消耗的氢氧化钠溶液的体积为20mL,所以V1/V2=3/2;
设恰好反应时氢氧化钠溶液中溶质的物质的量是n.
HCl+NaOH═NaCl+H2O
1 1
1.0mol?L-1×0.03L n
则n=1.0mol?L-1×0.03L=0.03mol,
所以浓度C=
| 0.03mol |
| 0.02L |
故答案为:1.5.
点评:本题考查了热化学方程式的计算和盖斯定律的计算应用,结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合,要认真分析解答理解实质,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
下列说法错误的是( )
| A、2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为2:1 | ||||
| B、4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2 | ||||
C、3I2+6KOH
| ||||
D、2FeS+6H2SO4(浓)
|
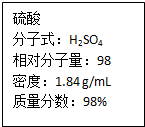 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: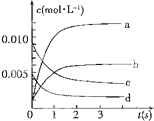 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表: 金属(M)的腐蚀是因为发生反应:M-ne-→Mrn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属(M)的腐蚀是因为发生反应:M-ne-→Mrn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大. (一)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(一)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题: