题目内容
将4mol A和2mol B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经10min后,测得D的浓度为0.5mol?L-1,C的平均反应速率是0.1mol/(L?min),求:
(1)10min后,B的平均反应速率?
(2)10min后,A的浓度是多少?
(3)x的值是多少?
(1)10min后,B的平均反应速率?
(2)10min后,A的浓度是多少?
(3)x的值是多少?
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:将4mol A和2mol B混合于2L的密闭容器中,c(A)=2mol/L,c(B)=1mol/L,经10min后,测得D的浓度为0.5mol?L-1,C的平均反应速率是0.1mol/(L?min),c(C)=1mol/L,依据反应速率之比等于化学方程式计量数之比,D的反应速率=0.05mol/L?min,x:2=0.1:0.05,x=4,依据化学三段式列式计算,
解答:
解:将4mol A和2mol B混合于2L的密闭容器中,c(A)=2mol/L,c(B)=1mol/L,经10min后,测得D的浓度为0.5mol?L-1,C的平均反应速率是0.1mol/(L?min),c(D)=1mol/L,依据反应速率之比等于化学方程式计量数之比,D的反应速率=0.05mol/L?min,x:2=0.1:0.05,x=4,依据化学三段式列式计算,
3A(g)+B(g)?4C(g)+2D(g)
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.75 0.25 1 0.5
10min末(mol/L) 0.25 0.75 1 0.5
(1)10min后,B的平均反应速率=
=0.025mol/L?min;
答:10min后,B的平均反应速率0.025mol/L?min;
(2)10min后,A的浓度=0.25mol/L;
答:10min后,A的浓度=0.25mol/L;
(3)依据上述计算得到x的值是4;
答:x的值是4;
3A(g)+B(g)?4C(g)+2D(g)
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.75 0.25 1 0.5
10min末(mol/L) 0.25 0.75 1 0.5
(1)10min后,B的平均反应速率=
| 0.25mol/L |
| 10min |
答:10min后,B的平均反应速率0.025mol/L?min;
(2)10min后,A的浓度=0.25mol/L;
答:10min后,A的浓度=0.25mol/L;
(3)依据上述计算得到x的值是4;
答:x的值是4;
点评:本题考查了化学竞赛应用,掌握基本计算方法和速率概念计算应用,速率之比等于化学方程式计量数之比,题目较简单.

练习册系列答案
相关题目
化学反应经常伴随着颜色变化,下列关于颜色的叙述正确的是( )
①钾的焰色反应--紫色
②淀粉碘化钾溶液遇碘离子--蓝色
③溴化银见光分解--白色
④适量的氯气通入KBr溶液--橙黄色
⑤新制氯水久置后--无色
⑥铜在氯气中燃烧产生的烟--棕黄色.
①钾的焰色反应--紫色
②淀粉碘化钾溶液遇碘离子--蓝色
③溴化银见光分解--白色
④适量的氯气通入KBr溶液--橙黄色
⑤新制氯水久置后--无色
⑥铜在氯气中燃烧产生的烟--棕黄色.
| A、①②③⑤ | B、①④⑤⑥ |
| C、②③④⑥ | D、①③⑤⑥ |
一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如下表.
下列叙述不正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A、0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L?min) |
| B、6~10min的平均反应速率:v(H202)<3.3×10-2mol/(L?min) |
| C、反应至6min时,c(H2O2)=0.30mol/L |
| D、反应至6min时,H2O2分解了50% |
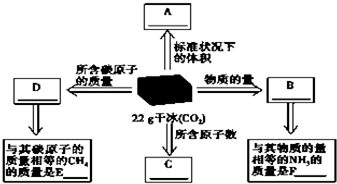 (1)干冰是固态CO2的俗称,常用做人工降雨,22g干冰与A、B、C、D有如图所示的转化关系,请完成图中方框.
(1)干冰是固态CO2的俗称,常用做人工降雨,22g干冰与A、B、C、D有如图所示的转化关系,请完成图中方框.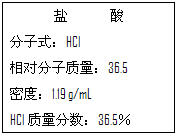 如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题: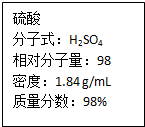 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: