题目内容
 如图是元素周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法不正确的是( )
如图是元素周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法不正确的是( )| A、原子半径:W>Y>Z |
| B、X的氢化物不如Z的氢化物稳定 |
| C、Y的氢化物比W的氢化物沸点高,是因为存在氢键 |
| D、常见的X的氢化物具有正四面体结构 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:这几种元素都是短周期元素,根据元素在周期表中的位置值,X、Y、Z都是第二周期元素,W是第三周期元素,Y和W属于同一族元素,Y和W原子能形成两种造成酸雨的有害气体,形成酸雨的有害气体是SO2、SO3,所以Y是O、W是S元素,则X是N元素、Z是F元素,
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其气态氢化物越稳定;
C.含有氢键的氢化物导致其沸点升高;
D.常见的X的氢化物是NH3,为三角锥形结构.
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其气态氢化物越稳定;
C.含有氢键的氢化物导致其沸点升高;
D.常见的X的氢化物是NH3,为三角锥形结构.
解答:
解:这几种元素都是短周期元素,根据元素在周期表中的位置值,X、Y、Z都是第二周期元素,W是第三周期元素,Y和W属于同一族元素,Y和W原子能形成两种造成酸雨的有害气体,形成酸雨的有害气体是SO2、SO3,所以Y是O、W是S元素,则X是N元素、Z是F元素,
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径W>Y>Z,故A正确;
B.元素的非金属性Z>X,所以其气态氢化物的稳定性Z>X,故B正确;
C.Y是O元素、Z是S元素,水中含有氢键、硫化氢中不含氢键,含有氢键的氢化物导致其沸点升高,所以税的沸点大于硫化氢,故C正确;
D.常见的X的氢化物是NH3,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,所以为三角锥形结构,故D错误;
故选D.
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径W>Y>Z,故A正确;
B.元素的非金属性Z>X,所以其气态氢化物的稳定性Z>X,故B正确;
C.Y是O元素、Z是S元素,水中含有氢键、硫化氢中不含氢键,含有氢键的氢化物导致其沸点升高,所以税的沸点大于硫化氢,故C正确;
D.常见的X的氢化物是NH3,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,所以为三角锥形结构,故D错误;
故选D.
点评:本题考查位置结构性质的相互关系及应用,侧重考查元素周期律、氢键、分子空间构型等知识点,熟练掌握物质的结构、性质即可解答,注意氢键只影响物质的物理性质不影响化学性质.

练习册系列答案
相关题目
下雪时,常用融雪剂清理路面,醋酸钾(CH3COOK)是效果较好的融雪剂.下列关于1molCH3COOK的叙述正确的是( )
| A、1 mol CH3COOK含有1 mol钾元素 |
| B、CH3COOK的摩尔质量为98 g |
| C、1molCH3COOK含有2 mol氧 |
| D、1molCH3COOK含有3×6.02×1023个H |
短周期元素X、Y的原子序数相差2.下列有关叙述正确的是( )
| A、X与Y可能形成XY化合物 |
| B、X与Y一定位于同一周期 |
| C、X与Y不可能位于同一主族 |
| D、X与Y都为主族元素 |
对于3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为( )
| ||
A、K=
| ||
B、K=
| ||
C、K=
| ||
D、K=
|

 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有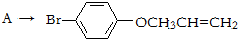 的有机反应类型:
的有机反应类型: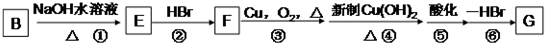
 实验设计:
实验设计: